题目内容
【题目】味精(主要成分的化学式为C5H8NO4 Na·H2O)中往往含少量食盐,某学生想测定某品牌味精的纯度,做了如下实验:
①称取某品牌的袋装味精样品1.000 g,放入烧杯中,加入蒸馏水溶解,恢复至室温;
②在烧杯中,加入稍过量的用稀硝酸酸化的A溶液,充分反应,使沉淀完全;
③过滤,用蒸馏水反复洗涤沉淀多次;
④将沉淀烘干、称量,所得固体质量为0.368 g。
根据上述实验操作,回答下列问题:
(1)加入的A溶液是________;检验加入的A溶液是否过量的方法是_______________________。
(2)沉淀洗涤是必不可少的一步,若沉淀不洗涤,测得的结果将_____________。
(3)烘干沉淀应采用的方法是________(填字母)。
A.低温烘干 B.高温烘干 C.利用太阳能晒干
(4)该品牌味精的纯度(即味精中C5H8NO4 Na·H2O的质量分数)为__________。
(5)写出味精和食盐中都含有的元素的离子结构示意图:___________。
【答案】
(1) AgNO3溶液;将烧杯静置,在上层清液中继续滴入AgNO3溶液,若无沉淀生成,说明已过量,否则不过量;(2)偏低;(3)A;(4)85.0%;(5) ![]() ;
;
【解析】
试题分析:(1)用银离子沉淀氯离子,A为硝酸酸化的硝酸银溶液;检验加入的A是否过量也就是检验氯离子是否沉淀完全,方法是取上层烧杯中清液于试管中加入少量硝酸银溶液,如果有沉淀产生说明不过量,如果没有沉淀产生说明过量,故答案为:硝酸银;取上层烧杯中清液于试管中加入少量硝酸银溶液,如果有沉淀产生说明不过量,如果没有沉淀产生说明过量;
(2)沉淀洗涤是必不可少的一步,若沉淀不洗涤,则得到的氯化银质量偏大,味精的含量偏少,故答案为:偏低;
(3)为防止沉淀分解应低温烘干,故答案为:A;
(4)沉淀为氯化银,氯化银与氯化钠的物质的量相等,则味精中氯化钠的质量分数为:![]() ×58.5g/mol÷1.0g×100%=15.0%,则味精的纯度为85.0%,故答案为:85.0%;
×58.5g/mol÷1.0g×100%=15.0%,则味精的纯度为85.0%,故答案为:85.0%;
(5)味精和食盐中都含有钠离子,钠离子核电荷数为11,核外电子数为10,钠离子的结构示意图为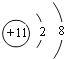 ,故答案为:
,故答案为: 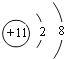 。
。