题目内容
二甲醚是一种绿色、可再生的新能源。如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极)。该电池工作时,下列说法不正确的是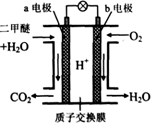
| A.a电极为该电池负极 |
| B.O2在b电极上得电子,被氧化 |
| C.电池工作时,a电极反应式: CH3OCH3—12e-+3H2O→2CO2↑+12H+ |
| D.电池工作时,燃料电池内部H+从a电极移向b电极 |
B
解析试题分析:A、二甲醚失去电子对应电极为负极,正确;B、O2在b电极上得电子,被还原,错误;C、正确;D、电池工作时,燃料电池内部H+从a电极(负极)移向b电极(正极),正确。
考点:考查原电池有关问题。

练习册系列答案
相关题目
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极极板,通过导线与直流电源相连。下列说法不正确的是 ( )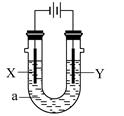
| A.若电镀铜,则Y为铜电极,电解液a可以是硫酸铜或氯化铜溶液 |
| B.若X为铁电极、Y为石墨电极,电解饱和氯化钠溶液一段时间,在两极分别滴加酚酞,X极变红色 |
| C.若用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.1mol的氢氧化铜溶解,刚好恢复到通电前的浓度,则电解过程中转移的电子为0.2mol |
| D.若X、Y为铂电极,a溶液为250mL CuSO4和KNO3的混合液,经过一段时间后,两极均得到标准状况下5.6L气体,则原混合液中CuSO4的物质的量浓度为1mol·L-1 |
下列叙述正确的是
| A.纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率加快 |
| B.甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为:CH3OH+6OH-+6e-=CO2↑+5H2O |
| C.在铁上镀铜时,金属铜作阴极 |
| D.电解MgCl2溶液可制得Mg单质 |
双隔膜电解池的结构示意简图如图所示,对该装置及其原理判断错误的是( )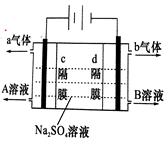
| A.c隔膜为阴离子交换膜、d隔膜为阳离子交换膜 |
| B.A溶液为硫酸,B溶液为氢氧化钠 |
| C.a气体为氢气,b气体为氧气 |
D.该电解反应的总方程式为:2Na2SO4+6H2O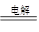 2H2SO4+4NaOH+O2↑+2H2↑ 2H2SO4+4NaOH+O2↑+2H2↑ |
下图的各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是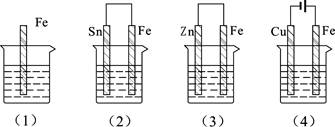
| A.⑷>⑵>⑴>⑶ | B.⑵>⑴>⑶>⑷ |
| C.⑷>⑵>⑶>⑴ | D.⑶>⑵>⑷>⑴ |
用惰性电极电解物质的量浓度相等的CuSO4、NaCl混合溶液,电解过程中不可能发生的反应是
A.2Cl-+Cu2+ Cu+Cl2↑ Cu+Cl2↑ |
B.2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
C.2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
D.2H2O 2H2↑+O2↑ 2H2↑+O2↑ |
根据下图,下列判断中正确的是
| A.烧杯a中的溶液H+增大 |
| B.烧杯b中发生氧化反应 |
| C.烧杯a中发生的反应为:2H+ +2e-=H2 |
| D.烧杯b中发生的反应为:2Cl--2e-=Cl2 |
镁燃料电池作为一种高能化学电源,具有良好的应用前景。下图是镁一空气燃料电池工作原理示意图。下列有关该电池的说法正确的是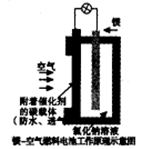
| A.该电池Mg作负极,发生还原反应 |
B.该电池的正极反应式为: |
| C.电池工作时,电子通过导线由碳电极流向Mg电极 |
| D.当电路中通过0.2mol电子时,消耗的O2体积为1.12L |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍。其电池反应为: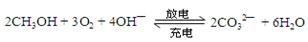
则下列说法错误的是
| A.放电时负极的电极反应为:CH3OH-6e-+8OH- = CO32— + 6H2O |
| B.充电时电解质溶液的pH逐渐增大 |
| C.放电时CH3OH参与反应的电极为正极 |
| D.充电时每生成1 mol CH3OH转移6 mol电子 |