��Ŀ����
����Ŀ��ij�о�С���Դ��κ�̼����泥�NH4HCO3��Ϊԭ�ϣ��������������Ʊ�������Ȼ�泥� ��֪�ε��ȷֽ��¶ȣ�NH4HCO3 36�棻 NaHCO3 270�棻 NH4Cl 340�棻 Na2CO3��850��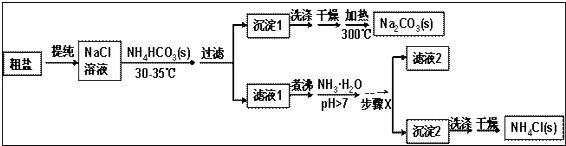
��1�������к���Ca2+��Mg2+��SO42�����������ӣ�ʹ�õ��Լ��У���NaOH ��BaCl2��HCl ��Na2CO3 �� ������˳��������� A���٢ۢܢ�B���٢ڢܢ�C���ۢڢܢ�D���٢ڢۢ�
�������õ���������������
��2������жϴ�����SO42���Ƿ��ѳ�������
��3����NaCl��Һ������1�Ĺ����У�������Ũ�����ڼ������NH4HCO3֮ǰ��������Ũ�������ڼ���NH4HCO3֮��ԭ������
��4��д������1���ȷֽ�Ļ�ѧ����ʽ��
��5��Ϊ���NH4Cl��Ʒ�IJ��ʺʹ��ȣ�������Һ�м��백ˮ���������� ����X�����IJ�������
��6�����á���ȩ�����ⶨ��ҵ��Ʒ���Ȼ�淋Ĵ��ȣ��ٶ����ʲ����ȩ��Ӧ������Ӧԭ��Ϊ��4NH4Cl+6HCHO����CH2��6N4+4HCl+6H2O ij������Ա��ȡ1.5g����Ʒ����ˮ�����������ļ�ȩ����ˮ���100mL��Һ������ȡ��10mL�������̪����0.1mol/L��NaOH��Һ�ζ������ζ��յ�ʱ����NaOH��Һ25.00mL�������Ʒ���Ȼ�淋���������Ϊ ��
���𰸡�
��1��B������
��2��ȡ�������Ӻ����Ʒ���Թ��У��μ������Ȼ�����Һ�����ް�ɫ������������SO42���ѳ���
��3���ɱ���NH4HCO3�ķֽ�
��4��2NaHCO3=��=Na2CO3+H2O+CO2��
��5������NH4+ˮ�⣬ʹNaHCO3ת��ΪNa2CO3 �� �������ʱ��ʧ��NH3������Ũ������ȴ�ᾧ������
��6��89.2%
���������⣺�����������̿�֪������ˮ�ᴿ����Ȼ�����Һ��������Ũ�����¶ȿ�����30�桫35�棬��ֹ̼���ⰴ�ֽ⣬����̼����泥����ɳ���1Ϊ̼�����ƣ���Һ1��ҪΪ�Ȼ�泥��Ȼ����Һ�м��백ˮ��������笠����ӵ�ˮ�⣬��������Ũ������ȴ�ᾧ�����˿ɵó���2Ϊ�Ȼ�粒��壬��ϴ�ӡ�����ô������Ȼ�泥���Һ2�к����������Ȼ�狀�̼�����ƣ���1�������к���Ca2+��Mg2+��SO42�����������ӣ�ʹ�õ��Լ��У���NaOH ��BaCl2��HCl ��Na2CO3 �� ����ǰ�����������ǹ����ģ��ں������������ڳ�ȥ��Һ��ԭ���������Ҫ��ǰ�������Լ����ʳ�ȥ�����Լ����˳��ΪNaOH��BaCl2��Na2CO3��HCl����ѡB���������õ����������������������ʴ�Ϊ��B����������2����Ʒ�м����������Ȼ�����Һ���жϴ�����SO42���Ƿ��ѳ������������Ϊȡ�������Ӻ����Ʒ���Թ��У��μ������Ȼ�����Һ�����ް�ɫ������������SO42���ѳ������ʴ�Ϊ��ȡ�������Ӻ����Ʒ���Թ��У��μ������Ȼ�����Һ�����ް�ɫ������������SO42���ѳ�������3������Ũ��ʱ��ҺҪ���ȣ���NH4HCO3��36�濪ʼ�ֽ⣬�����ڼ������NH4HCO3֮ǰ��������Ũ�������ڼ���NH4HCO3֮��ԭ���ǿɱ���NH4HCO3�ķֽ⣬�ʴ�Ϊ���ɱ���NH4HCO3�ķֽ⣻��4��̼���������ȷֽ�����̼���ơ�������̼��ˮ����Ӧ����ʽΪ2NaHCO3 ![]() Na2CO3+H2O+CO2�����ʴ�Ϊ��2NaHCO3
Na2CO3+H2O+CO2�����ʴ�Ϊ��2NaHCO3 ![]() Na2CO3+H2O+CO2������5����ˮ������笠����ӵ�ˮ�⣬ͬʱ��ʹNaHCO3ת��ΪNa2CO3 �� ���������ʱ��ʧ��NH3 �� ���Ȼ����Һ�õ��Ȼ�粒������ͨ������Ũ������ȴ�ᾧ�����˵ķ����� �ʴ�Ϊ������NH4+ˮ�⡢ʹNaHCO3ת��ΪNa2CO3���������ʱ��ʧ��NH3������Ũ������ȴ�ᾧ�����ˣ���6���������⣬�ζ���ȥ���������Ƶ����ʵ���Ϊ0.025L��0.1mol/L=0.0025mol��������������ʵ���Ϊ0.0025mol�����ݷ���ʽ4NH4Cl+6HCHO����CH2��6N4+4HCl+6H2O����֪1.5g����Ʒ���Ȼ�淋�����Ϊ0.0025mol��
Na2CO3+H2O+CO2������5����ˮ������笠����ӵ�ˮ�⣬ͬʱ��ʹNaHCO3ת��ΪNa2CO3 �� ���������ʱ��ʧ��NH3 �� ���Ȼ����Һ�õ��Ȼ�粒������ͨ������Ũ������ȴ�ᾧ�����˵ķ����� �ʴ�Ϊ������NH4+ˮ�⡢ʹNaHCO3ת��ΪNa2CO3���������ʱ��ʧ��NH3������Ũ������ȴ�ᾧ�����ˣ���6���������⣬�ζ���ȥ���������Ƶ����ʵ���Ϊ0.025L��0.1mol/L=0.0025mol��������������ʵ���Ϊ0.0025mol�����ݷ���ʽ4NH4Cl+6HCHO����CH2��6N4+4HCl+6H2O����֪1.5g����Ʒ���Ȼ�淋�����Ϊ0.0025mol�� ![]() ��53.5g/mol=1.3375g��������Ʒ���Ȼ�淋���������Ϊ
��53.5g/mol=1.3375g��������Ʒ���Ȼ�淋���������Ϊ ![]() ��100%=89.2%���ʴ�Ϊ��89.2%��
��100%=89.2%���ʴ�Ϊ��89.2%��
�����������̿�֪������ˮ�ᴿ����Ȼ�����Һ��������Ũ�����¶ȿ�����30�桫35�棬��ֹ̼���ⰴ�ֽ⣬����̼����泥����ɳ���1Ϊ̼�����ƣ���Һ1��ҪΪ�Ȼ�泥��Ȼ����Һ�м��백ˮ��������笠����ӵ�ˮ�⣬��������Ũ������ȴ�ᾧ�����˿ɵó���2Ϊ�Ȼ�粒��壬��ϴ�ӡ�����ô������Ȼ�泥���Һ2�к����������Ȼ�狀�̼�����ƣ���1�������к���Ca2+��Mg2+��SO42�����������ӣ�ʹ�õ��Լ��У���NaOH ��BaCl2��HCl ��Na2CO3 �� ����ǰ�����������ǹ����ģ��ں������������ڳ�ȥ��Һ��ԭ���������Ҫ��ǰ�������Լ����ʳ�ȥ���ݴ��жϣ��������õ�����������������������2����Ʒ�м����������Ȼ�����Һ���жϴ�����SO42���Ƿ��ѳ�������3������Ũ��ʱ��ҺҪ���ȣ���NH4HCO3��36�濪ʼ�ֽ⣬�ݴ˴��⣻��4��̼���������ȷֽ�����̼���ơ�������̼��ˮ����5����ˮ������笠����ӵ�ˮ�⣬ͬʱ��ʹNaHCO3ת��ΪNa2CO3 �� ���������ʱ��ʧ��NH3 �� ���Ȼ����Һ�õ��Ȼ�粒������ͨ������Ũ������ȴ�ᾧ�����˵ķ�������6���ɵζ���ȥ���������Ƶ����ʵ����������������ʵ��������ݷ���ʽ4NH4Cl+6HCHO����CH2��6N4+4HCl+6H2O��������Ȼ�淋������������������Ʒ���Ȼ�淋�����������

 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д� ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�����Ŀ�����������ǻ�ѧʵ������Ҫ����ɲ��֣� ���к��ȵIJⶨ��
��1����ʵ�����У���50mL 0.40mol/L��������50mL 0.50mol/L��NaOH��Һ��Ӧ�ⶨ���ȣ������ʱ��Һ�ܶȾ�Ϊ1g/cm3 �� ������Һ�ı�����c=4.18J/��g�棩��ʵ����ʼ�¶�ΪT1�棬��ֹ�¶�ΪT2�棬��д���к��ȵļ���ʽ ��д�����������H=KJ/mol��
��2��1L1mol/LH2SO4��Һ��2L1mol/LNaOH��Һ��ȫ��Ӧ���ų�114.6kJ����������д����ʾ�÷�Ӧ�к��ȵ��Ȼ�ѧ����ʽ ��
��3���ζ�ԭ��Ϊ���������ӷ���ʽ��ʾ����
��4���ζ�ʱ��KMnO4��ҺӦװ�������ʽ����ʽ�����ζ����У��ﵽ�ζ��յ�ʱ����ɫ�仯Ϊ ��
��5����ͼ��ʾ50mL�ζ�����Һ���λ�ã���ʱ�ζ�����Һ��Ķ���ΪmL�� 
��6��Ϊ�˼�Сʵ������ͬѧһ������������ʵ�飬����ÿ����ȡH2C2O4��Һ�����ΪVmL������ʵ������¼�����
ʵ����� | ��һ�� | �ڶ��� | ������ |
����KMnO4��Һ���/mL | 26.32 | 24.02 | 23.98 |
���ϱ����Կ�������һ��ʵ���м�¼����KMnO4��Һ��������Զ��ں����Σ���ԭ�������
A.ʵ�����ʱ���ӿ̶��߶�ȡ�ζ��յ�ʱKMnO4��Һ�����
B.�μ�KMnO4��Һ���죬δ������տ�����Һ��ɫ������ֹͣ�ζ�
C.��һ�εζ�ʢװ��Һ�ĵζ���װҺǰ������ˮ��ϴ����δ�ñ�Һ��ϴ�������ξ��ñ�Һ��ϴ
D.��һ�εζ��õ���ƿ�ô�װҺ��ϴ����������δ��ϴ
��7��д������H2C2O4�����ʵ���Ũ�ȵ�������ʽ��C=mol/L��
