题目内容
镁铝合金溶于适量盐酸后,再加入过量烧碱溶液, 溶液中可能大量存在的离子是( )
A. Na+、Mg2+、Al3+、Cl- B. Na+、[Al(OH)4]-、Cl- 、OH-
C. Na+、Mg2+、[Al(OH)4]-、Cl- D. Na+、Al3+、[Al(OH)4]-、Cl-
练习册系列答案
相关题目
某学生探究如下实验(A):
实验A | 条件 | 现象 |
| 加热 | i.加热后蓝色褪去 ii.冷却过程中,溶液恢复蓝色 ⅲ.一段时间后,蓝色重又褪去 |
(1)使淀粉变蓝的物质是____。
(2)分析现象i、ii认为:在酸性条件下,加热促进淀粉水解,冷却后平衡逆向移动。
设计实验如下,“现象a”证实该分析不合理:
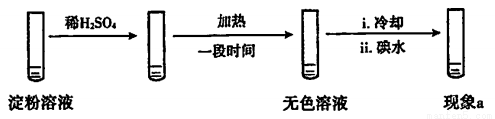
“现象a”是____。
(3)再次分析:加热后单质碘发生了变化,实验如下:
I:取少量碘水,加热至褪色,用淀粉溶液检验挥发出的物质,变蓝。
Ⅱ:向褪色后的溶液中滴加淀粉溶液,冷却过程中一直未变蓝;加入稀H2SO4,瞬间变蓝。
对步骤Ⅱ中稀H2SO4的作用,结合离子方程式,提出一种合理的解释:______________。
(4)探究碘水褪色后溶液的成分:
实验1:测得溶液的pH≈5
实验2:取褪色后的溶液,完成如下实验:
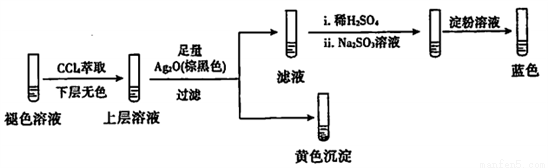
①产生黄色沉淀的离子方程式是____。
②Ag2O的作用是____________。
③依据上述实验,推测滤液中含有的物质(或离子)可能是_________。
(5)结合化学反应速率解释实验A中现象i、现象iii蓝色褪去的原因:_______________。




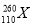 (暂用X表示),它属于一种新元素——第110号元素,这种新元素是有史以来制得的最重的元素,存在时间不到千分之一秒,经分析它属于过渡元素,下列关于该元素的叙述中正确的是( )
(暂用X表示),它属于一种新元素——第110号元素,这种新元素是有史以来制得的最重的元素,存在时间不到千分之一秒,经分析它属于过渡元素,下列关于该元素的叙述中正确的是( )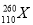 )的中子数为169
)的中子数为169
