题目内容
实验室用高锰酸钾与浓盐酸反应制取Cl 2:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
(1)该反应的氧化剂是 ,氧化产物是 ;
(2)当有15.8g KMnO4参加反应时,被氧化的还原剂有 mol,标况下生成Cl 2的体积为________________L,转移电子的数目为 。
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
(1)该反应的氧化剂是 ,氧化产物是 ;
(2)当有15.8g KMnO4参加反应时,被氧化的还原剂有 mol,标况下生成Cl 2的体积为________________L,转移电子的数目为 。
(1)KMnO4(2分); Cl2(2分)
(2)0.5(2分); 5.6(2分)0.5N A(2分)
(2)0.5(2分); 5.6(2分)0.5N A(2分)
试题分析:(1)反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,化合价升高的Cl元素所在的HCl反应物是还原剂,Cl2为氧化产物,化合价降低的Mn元素所在的反应物KMnO4是氧化剂,故答案为:高锰酸钾,Cl2;
(2)由方程式得如下关系式:
2KMnO4~10HCl(被氧化)~5Cl2 ~ 10e-
2×158g 10mol 5×22.4L 10NA
15.8g 0.5mol 5.6L 0.5NA
答案:0.5(2分); 5.6(2分)0.5N A(2分)

练习册系列答案
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
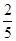 mol
mol mol
mol mol
mol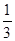 mol
mol
