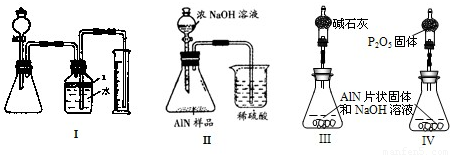
题目内容
新型无机非金属材料甲和乙均是高温陶瓷材料,硬度大、熔点高、化学性质稳定。甲、乙分别由原子序数依次增大的X、Y、Z三种短周期元素中的两种组成。甲与NaOH浓溶液共热生成气体丙和化合物丁,丙在标准状况下的密度为0.76g·L-1,在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解。Z元素的氧化物是制造光导纤维的主要材料,在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙。请回答下列问题:
(1)乙的化学式为__________;丙的电子式为__________。
(2)甲与NaOH浓溶液共热的化学方程式为__________________________________________。
(3)丁溶液中通入少量CO2的离子方程式为________________________________________。
(4)高温条件下,丙与Fe2O3反应生成Fe和X单质,写出该反应的化学方程式为____________________,有人提出生成的产物Fe中可能还有FeO,请设计实验方案验证之(用化学方法)____________________。
(5)工业上在X单质的气氛下将Z的氧化物和焦炭加热到1400℃~1450℃的条件下以制备乙,反应中还生成一种常见的可燃性气体戊,该反应的化学方程式为____________________。
(1)Si3N4(2分);
 (2分)
(2分)
(2)AlN+ NaOH +H2O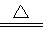 NaAlO2 + NH3↑(2分)
NaAlO2 + NH3↑(2分)
(3)2AlO2-+CO2+3H2O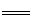 2Al(OH)3+CO32-(2分)
2Al(OH)3+CO32-(2分)
(4)Fe2O3 +2NH3 2Fe +N2 +3H2O(2分) ,? 取样品少许,溶于足量的CuSO4溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加 KSCN溶液无现象,再滴加氯水,若溶液呈红色,则证明有FeO生成(2分,其他合理答案也给分)
2Fe +N2 +3H2O(2分) ,? 取样品少许,溶于足量的CuSO4溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加 KSCN溶液无现象,再滴加氯水,若溶液呈红色,则证明有FeO生成(2分,其他合理答案也给分)
(5)3SiO2 +2N2 +6C Si3N4 +6CO(2分)
Si3N4 +6CO(2分)
【解析】
试题分析:丙在标准状况下的密度为0.76g·L-1,根据M=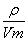 =0.76g·L-1×22.4L·mol-1≈17g·mol-1,所以丙为NH3,甲中含有N元素;在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解,说明丁中含有铝元素,则甲中含有Al元素,故甲为AlN;丙为铝的化合物,又是与氢氧化钠溶液生成的化合物,所以丙为NaAlO2;Z元素的氧化物是制造光导纤维的主要材料,所以Z为Si元素,而X、Y、Z三种短周期元素且原子序数依次增大,所以X为N、Y为Al,Z为Si;在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙,即:0.1mol氮气与0.15molSi反应,生成的乙中氮原子与硅原子个数之比为:0.2:0.15=4:3,所以乙的化学式为:Si3N4;
=0.76g·L-1×22.4L·mol-1≈17g·mol-1,所以丙为NH3,甲中含有N元素;在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解,说明丁中含有铝元素,则甲中含有Al元素,故甲为AlN;丙为铝的化合物,又是与氢氧化钠溶液生成的化合物,所以丙为NaAlO2;Z元素的氧化物是制造光导纤维的主要材料,所以Z为Si元素,而X、Y、Z三种短周期元素且原子序数依次增大,所以X为N、Y为Al,Z为Si;在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙,即:0.1mol氮气与0.15molSi反应,生成的乙中氮原子与硅原子个数之比为:0.2:0.15=4:3,所以乙的化学式为:Si3N4;
(1)根据以上分析可知,乙的化学式为:Si3N4;丙为氨气,氨气为共价化合物,氨气的电子式为: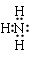 ;
;
(2)甲为AlN,AlN与NaOH浓溶液共热生成了氨气和偏铝酸钠,反应的化学方程式为:AlN+NaOH+H2O NaAlO2+NH3↑;
NaAlO2+NH3↑;
(3)丁溶液为偏铝酸钠溶液,偏铝酸根离子与二氧化碳反应生成氢氧化铝沉淀,反应的离子方程式为:2AlO2-+3H2O+CO2 2Al(OH)3↓+CO32-;
2Al(OH)3↓+CO32-;
(4)丙为氨气,X的单质为氮气,高温条件下,氨气与Fe2O3反应生成Fe和氮气单质,反应的化学方程式为:2NH3+Fe2O3 2Fe+3H2O+N2;产物Fe中可能还有FeO,需要先除掉铁,然后用盐酸溶解,再检验是否含有亚铁离子,方法为:取样品少许,溶于足量的硫酸铜溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加硫氰化钾溶液,没有明显现象,再滴加氯水,若溶液呈红色,则证明有FeO生成;
2Fe+3H2O+N2;产物Fe中可能还有FeO,需要先除掉铁,然后用盐酸溶解,再检验是否含有亚铁离子,方法为:取样品少许,溶于足量的硫酸铜溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加硫氰化钾溶液,没有明显现象,再滴加氯水,若溶液呈红色,则证明有FeO生成;
(5)X的单质为N2,Z的氧化物为SiO2,工业上在N2的气氛下将Z的氧化物SiO2和焦炭加热到1400℃~1450℃的条件下以制备乙,乙为Si3N4,反应中还生成一种常见的可燃性气体戊,根据原子守恒,可燃性气体中含有C,所以为CO,该反应的化学方程式为:SiO2+2N2+6C Si3N4+6CO。
Si3N4+6CO。
考点:本题考查无机物的推断,题目难度较大,试题涉及了化学式、电子式的书写、化学方程式、离子方程式的书写、亚铁离子的检验等知识。

 2AlN+3CO
2AlN+3CO
 2AlN+3CO
2AlN+3CO