题目内容
【题目】A、B、C、D是原子序数小于20的四种元素,已知A元素+1价的阳离子与B、D的阴离子具有相同的电子层结构,B元素最高正价与负价的绝对值之差等于6.lmolC单质与足量的稀硫酸反应可生成1.5molH2 , 反应后C元素原子形成的离子和氖原子的电子层结构相同.D元素原子的最外层电子数是C元素原子的最外层电子数的2倍. 试回答:
(1)A,B,C,D四种元素依次是(写出元素名称).
(2)写出A与C、B与D最高价氧化物的水化物的化学式(按酸性或碱性由强至弱的顺序)
(3)写出A,C两元素最高价氧化物的水化物间反应的化学方程式
(4)请用电子式表示化合物A2O的形成过程: .
【答案】
(1)钾、氯、铝、硫
(2)碱性:KOH>Al(OH)3 , 酸性:HClO4>H2SO4
(3)KOH+Al(OH)3=KAlO2+2H2O
(4)![]()
【解析】解:A、B、C、D是原子序数小于20的四种元素,B元素最高正价的绝对值与负价的绝对值之差等于6,则B为第ⅦA族元素,F元素没有正化合价,所以B为氯元素;A元素+1价的阳离子与B、D的阴离子具有相同的电子层结构,即核外电子数为18,则A为K元素;lmolC单质与足量的稀硫酸反应可生成1.5molH2 , 则C为金属,根据电子转移守恒可知,C原子最外层电子数为3,可推知C为Al;D元素原子的最外层电子数是C元素原子的最外层电子数的2倍,故D原子最外层电子数为6,D离子核外电子数为18,则D为S元素.(1)由上述分析可知,A、B、C、D四种元素依次是:钾、氯、铝、硫, 所以答案是:钾、氯、铝、硫(2)A与C最高价氧化物对应水化物分别为KOH、Al(OH)3 , 金属性K>Al,故碱性:KOH>Al(OH)3 ,
B与D最高价氧化物的水化物分别为HClO4、H2SO4 , 非金属性Cl>S,故酸性:HClO4>H2SO4 ,
所以答案是:碱性:KOH>Al(OH)3 , 酸性:HClO4>H2SO4;
·(3)A与C最高价氧化物对应水化物分别为KOH、Al(OH)3 , 二者反应生成偏铝酸钾与水,反应方程式为:KOH+Al(OH)3=KAlO2+2H2O,
所以答案是:KOH+Al(OH)3=KAlO2+2H2O;(4)用电子式表示化合物K2O的形成过程: ![]() ,
,
所以答案是: ![]() .
.

【题目】A、B、C、D、E是中学化学中五种常见元素,有关信息如下:
元素 | 有关信息 |
A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
B | 地壳中含量最多的元素 |
C | 单质须保存在煤油中 |
D | 单质与NaOH溶液反应可用于生产漂白液 |
E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题:
(1)A的氢化物分子的电子式是 , 其最高价氧化物对应的水化物与其氢化物反应的离子方程式: .
(2)B,C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为 .
(3)A、D的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法及现象是: , 证明存在该阳离子.
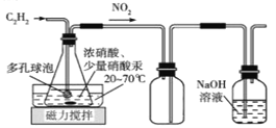
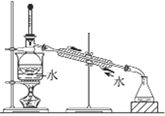
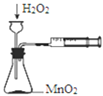
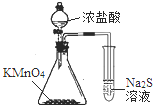
【题目】利用下列装置和操作不能达到实验目的的是( )
|
|
|
|
A.从含碘CCl4溶液中提取碘和回收CCl4溶剂 | B.萃取操作过程中的放气 | C.定量测定化学反应速率 | D.比较KMnO4、Cl2、S的氧化性 |
A. A B. B C. C D. D