题目内容
【题目】铜是一种重要的战略物资,以黄铜矿(主要成分是CuFeS2)为主要原料生产铜、铁红、单质硫时,原料的综合利用率较高,其主要流程如图所示(己知Na[CuCl2]的电离方程式为:Na[CuCl2]=Na++[CuCl2]-):
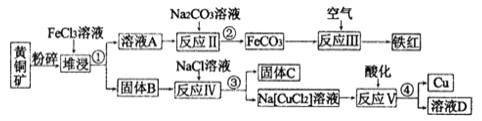
(1)流程中粉碎的目的是_____________,操作①、②、③、④的目的相同,在实验中这种操作的名称是____________。
(2)铁红的重要用途:__________________,固体B中含有两种产物,一种是单质C、另一种是原子个数比为1:l 的一种金属的低价态盐,写出堆浸时反应的化学方程式:________。
(3)反应V的离子方程式:___________________。
(4)此方法中得到的铜纯度不能满足某些生产的需要,需要利用电解法进行提纯。若用如图所示的装置进行电解精炼,则乙中溶液的溶质是_________,e电极上的电极反应式为_____。
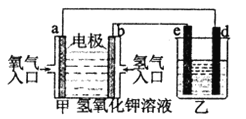
若当电路中有2mol电子通过时,乙中某个电极质量减轻了63.92g,则粗铜的纯度为(假设杂质只有铁且精炼时铜与铁的放电比例与混合物比例相同,计算时用%表示保留一位小数)____________(已知相对原子质量:Fe 56 Cu 64 )。
【答案】增大反应物间的接触面积,加快反应速率,使反应更充分过滤红色油漆和涂料CuFeS2+3FeCl3=4FeCl2+CuCl↓+2S↓2[CuCl2]ˉ=Cu+Cu2++4ClˉCuSO4Cu2++2eˉ=Cu99.1%
【解析】氯化铁具有氧化性,能氧化黄铜矿,根据(2)中提示,固体B中含有两种产物,一种是单质C、另一种是原子个数比为1:l 的一种金属的低价态盐,可知反应①为CuFeS2+3Fe3++Cl-=4Fe2++CuCl↓+2S↓,然后过滤得到固体CuCl和S和滤液,向滤液中加入碳酸钠发生反应Ⅱ,发生的离子反应方程式为Fe2++CO32-=FeCO3↓,过滤得到FeCO3,在空气中灼烧FeCO3得到氧化铁,反应Ⅲ为4FeCO3+O2 ![]() 2Fe2O3+4CO2;向CuCl、S的混合物中加入NaCl溶液,发生反应Ⅳ为Cl-+CuCl=[CuCl2]-,过滤得到Na[CuCl2],再加入水发生反应V生成Cu和溶液D,Cu+在反应V中发生自身氧化还原反应,歧化为Cu2+和Cu,则D为CuCl2、NaCl。
2Fe2O3+4CO2;向CuCl、S的混合物中加入NaCl溶液,发生反应Ⅳ为Cl-+CuCl=[CuCl2]-,过滤得到Na[CuCl2],再加入水发生反应V生成Cu和溶液D,Cu+在反应V中发生自身氧化还原反应,歧化为Cu2+和Cu,则D为CuCl2、NaCl。
(1)将矿石粉碎,可以增大与氯化铁溶液的接触面积,从而加快反应速率;根据流程图,操作①、②、③、④都是过滤,故答案为:增大反应物间的接触面积,加快反应速率,使反应更充分;过滤;
(2)铁红常用作红色油漆和涂料;固体B中含有CuCl和S,堆浸时反应的化学方程式为CuFeS2+3FeCl3=4FeCl2+CuCl↓+2S↓,故答案为:CuFeS2+3FeCl3=4FeCl2+CuCl↓+2S↓;
(3)反应V的离子方程式为2[CuCl2]ˉ=Cu+Cu2++4Clˉ,故答案为:2[CuCl2]ˉ=Cu+Cu2++4Clˉ;
(4)电解精炼铜,用粗铜作阳极,精铜作阴极,硫酸铜溶液作电解质溶液;根据图示,通入氢气的为负极,则 e电极为阴极,发生还原反应,电极反应式为Cu2++2eˉ=Cu;设粗铜中反应的铜的物质的量为x,铁为y,阳极反应为Cu-2eˉ=Cu2+、Fe-2eˉ= Fe 2+,则2x+2y=2mol,64x+56y=63.92g,解得x=0.99mol,y=0.01mol,粗铜的纯度为![]() ×100%=99.1%,故答案为:CuSO4 ;Cu2++2eˉ=Cu;99.1%。
×100%=99.1%,故答案为:CuSO4 ;Cu2++2eˉ=Cu;99.1%。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】(1)已知25 ℃时有关弱酸的电离平衡常数:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
① 同温度下,等pH值的a. NaHCO3、b. NaCN、c.Na2CO3溶液的物质的量浓度由大到小的顺序为__________(填序号)。
② 25 ℃时,将20mL 0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20ml0.1mol/L NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
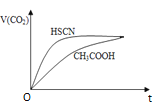
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:________反应结束后所得两溶液中,c(SCN-)________c(CH3COO-)(填“> ”、“< ”或“= ”)
③ 若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是______(填序号)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
(2)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。己知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ mol-1
2NO2(g)![]() N2O4(g) △H=-56.9kJ mol-1
N2O4(g) △H=-56.9kJ mol-1
H2O(g)=H2O(l) △H=-44.0kJ mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式_________
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:请回答下列问题:
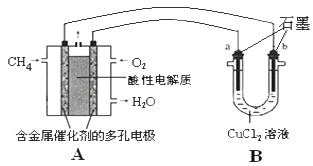
①甲烷燃料电池的负极反应式是____________
② 当A中消耗0.15mol氧气时.B 中____极增重_______g。