题目内容
下列图示与对应的叙述相符的是
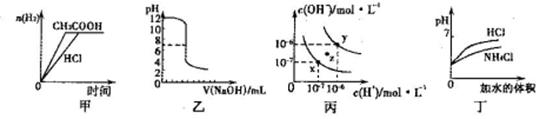

| A.甲图曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中分别加人足量镁粉产生H2的物质的量的变化 |
| B.乙表示将0.01mol·L-lNaOH溶液滴人到稀盐酸中的滴定曲线 |
| C.丙为水的电离曲线,从z点刭x点,可采用在水中加入适量NaOH固体的方法 |
| D.丁中曲线表示将pH相同的NH4C1溶液和盐酸稀释相同倍数时,二者pH的变化 |
D
试题分析:A、醋酸是弱酸,盐酸是强酸,因此在物质的量浓度相同的情况下,盐酸与镁反应的反应速率快,A不正确;B、乙应该表示的是将稀盐酸滴人到0.01mol·L-lNaOH溶液中的滴定曲线,B不正确;C、丙为水的电离曲线,从z点刭x点,水的离子积常数减小,因此不能采用在水中加入适量NaOH固体的方法实现,C不正确;D、盐酸是强酸,完全电离,氯化铵是强酸弱碱盐,NH4+水解溶液显酸性。因此在pH相同的条件下分别稀释相同倍数时,盐酸的pH变化大,D正确,答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

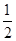 N2(g)+CO2(g),ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+CO2(g),ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( ) 2NH3(g) ΔH<0的速度为v,若降低温度,正反应速率加大
2NH3(g) ΔH<0的速度为v,若降低温度,正反应速率加大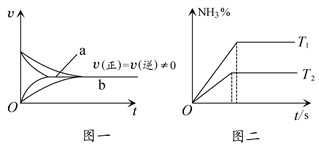
 2NH3(g) ΔH=-92.4 kJ/mol。1L密闭恒容容器中,反应体系中各物质浓度随时间变化的曲线如图示。下列说法错误的是( )
2NH3(g) ΔH=-92.4 kJ/mol。1L密闭恒容容器中,反应体系中各物质浓度随时间变化的曲线如图示。下列说法错误的是( )
 2NH3(g),容器体积固定不变时,充入Ar
2NH3(g),容器体积固定不变时,充入Ar 2C(g) ΔH<0 的正确图像是下图中的( )
2C(g) ΔH<0 的正确图像是下图中的( )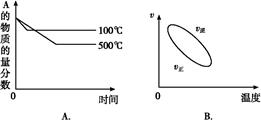
 CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( ) H2(g) +CO2(g) ΔH<0,改变其中一种条件,能加快反应速率且反应放出的热量不变的是
H2(g) +CO2(g) ΔH<0,改变其中一种条件,能加快反应速率且反应放出的热量不变的是