题目内容
【题目】某兴趣小组的同学设计了如下装置进行试验探究,请回答下列问题:

(1)为准确读取量气管的读数,除视线应与量气管凹液面最低处向平,还应注意 。若考虑分液漏斗滴入烧瓶中液体的体积(假设其它操作都正确),则测得气体的体积将 (填“偏大”、“偏小”或“无影响”)。
(2)若在烧瓶中放入生铁,用此装置验证生铁在潮湿空气中发生吸氧腐蚀。
①通过分液漏斗向烧瓶中加入的试剂可选用下列 (填序号)
a.NaOH溶液 B.C2H5OH c.NaCl溶液 D.稀硫酸
②能证明生铁在潮湿空气中发生吸氧腐蚀的现象是 。
(2)若烧瓶中放入粗铜片(杂质不参与反应),分液漏斗内放稀硝酸,通过收集并测量NO气体的体积来探究粗铜样品的纯度。你认为此方法是否可行 (填“可行”或“不可行”,若填“不可行”请说明原因)。
(3)为探究MnO2在H2O2制取O2过程中的作用,将等量的H2O2加入烧瓶中,分别进行2次实验(气体体积在同一状况下测定):
序号 | 烧瓶中的物质 | 测得气体体积 |
实验1 | 20 mL H2O2,足量MnO2 | V1 |
实验2 | 20 mL H2O2,足量MnO2和稀硫酸 | V1<V2<2V1 |
若实验1中MnO2的作用是催化剂,则实验2中发生反应的化学方程式为 。
(4)若烧瓶中放入镁铝合金,分液漏斗内放NaOH溶液,分别进行四次实验,测得以下数据(气体体积均已换算成标准状况):
编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
Ⅰ | 1.0 g | 10.00 mL | 346.30 mL |
Ⅱ | 1.0 g | 10.00 mL | 335.50 mL |
Ⅲ | 1.0 g | 10.00 mL | 346.00 mL |
Ⅳ | 1.0 g | 10.00 mL | 345.70 mL |
则镁铝合金中镁的质量分数为 。
【答案】8.(1)冷却至室温后,量气筒中和漏斗中的两液面相平;无影响
(2)①ac ②量气管中液面下降
(3)不可行 NO会与装置中O2、H2O发生反应生成HNO3,使测得的NO不准
(4)H2O2+MnO2+2H+=Mn2++2H2O+O2↑、2H2O2![]() 2H2O+O2↑ (5)73%
2H2O+O2↑ (5)73%
【解析】
试题分析:(1) 读数时应注意:①将实验装置恢复到室温;②上下调节右管,使右管液面高度与测量气管中液面高度平齐;③视线与凹液面最低处相平,所以为准确读取量气管的读数,除视线应与量气管凹液面最低处向平,还应注意冷却至室温后,量气筒中和漏斗中的两液面相平;只要上下调节右管,使右管液面高度与测量气管中液面高度平齐,就能使内外气压相等,则测得气体的体积将无影响。
(2)①钢铁在中性或弱碱性环境中易发生吸氧腐蚀,所以通过分液漏斗向烧瓶中加入的试剂是ac;
②吸氧腐蚀消耗氧气,所以量气管中液面下降。
(3)若烧瓶中放入粗铜片(杂质不参与反应),分液漏斗内放稀硝酸,通过收集并测量NO气体的体积来探究粗铜样品的纯度,该方法不可行,因为NO会与装置中O2、H2O发生反应生成HNO3,使测得的NO不准。
(4)若实验1中MnO2的作用是催化剂,双氧水完全反应生成气体的体积为V1,而实验2中生成气体的体积为V1<V2<2V1,说明除发生了实验1的反应外,还有其它反应发生,所以实验2发生反应的化学方程式为H2O2+MnO2+2H+=Mn2++2H2O+O2↑、2H2O2![]() 2H2O+O2↑。
2H2O+O2↑。
(5)编号Ⅱ的实验数据误差较大,舍弃,求其它三个体积的平均值,V=(336.30+336.00+335.70)÷3=336.0mL,根据化学反应2Al+2NaOH+2H2O = 2NaAlO2+3H2↑,氢气的物质的量为0.015mol,则参加反应的铝的物质的量为0.01mol,铝的质量为0.01mol×27g/mol=0.27g,则镁铝合金中镁的质量分数为(1-0.27)÷1×100%=73%。

【题目】含氮化合物在材料方面的应用越来越广泛。
(1)甲胺(CH3NH2)是合成太阳能敏化剂的原料。工业合成甲胺原理:
CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。
CH3NH2(g)+H2O(g)△H。
①已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 | C-H | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的△H=______________。
②一定条件下,在体积相同的甲、乙、丙、丁四个容器中,起始投入物质如下:
NH3(g)/mol | CH3OH(g)/mol | 反应条件 | |
甲 | 1 | 1 | 498K,恒容 |
乙 | 1 | 1 | 598K,恒容 |
丙 | 1 | 1 | 598K,恒压 |
丁 | 2 | 3 | 598K,恒容 |
达到平衡时,甲、乙、丙、丁容器中的CH3OH转化率由大到小的顺序为_______________。
(2)工业上利用镓(Ga)与NH3在高温下合成固体半导体材料氮化镓(GaN),其反应原理为2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
①在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。图中A点与C点的化学平衡常数分别为KA和KC,下列关系正确的是_________(填代号)。

a.纵轴a表示NH3的转化率 b.纵轴a表示NH3的体积分数 c.T1<T2 d.KA<Kc
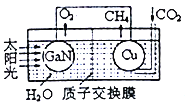
②镓在元素周期表位于第四周期第ⅢA族,化学性质与铝相似。氮化镓性质稳定,不溶于水,但能缓慢溶解在热的NaOH溶液中,该反应的离子方程式为_____________________。
(3)用氮化镓与铜组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成CH4。铜电极表面发生的电极反应式为___________。两电极放出O2和CH4相同条件下的体积比为________,为提高该人工光合系统的工作效率,可向装置中加入少量的__________(填“盐酸”或“硫酸”)。