题目内容
A、B、R、D、E、F是六种原子序数依次增大的短周期元素, 其中有两种非金属元素位于同一主族。已知A、B、D均能与R形成原子(或离子)个数不同的几种常见化合物。请回答下列有关问题。
(1)仅由上述信息就可以确定的元素(写出代号与元素符号)是________________,若X、Y是D、F形成的最高价氧化物对应的水化物,浓度均为0.1mol/L的X、Y溶液的pH之和为14,则X、Y的晶体熔点相对高低为(写化学式)______ ______
(2) A与B、E均可形成正四面体构型的气态分子Q、P,又知P的燃烧热为1430kJ/mol,则其燃烧的热化学方程式___________ _________
(3) 上述六种元素间能形成多种常见二元化合物,其中存在两类化学键的物质的电子式为_____ __(写一种即可)
(4) R能形成多种单质,如R2、R3,研究表明,新近制得的一种组成为R4的分子中,每个R原子均与另外两个R原子各形成一个键,下列有关R4的说法中正确的是__ _____
①R4与R3、R2互为同位素 ②R4不能与A、B、D的单质反应
③R4中各原子最外电子层均为8电子结构 ④R4是一种新型化合物
【答案】
(1)R:O,NaOH >HClO4;
(2)SiH4(g)+2O2(g)=SiO2(s)+2H2O(l);△H=-1430kJ/mol
(3) 过氧化钠的电子式 (4) ③
【解析】

练习册系列答案
相关题目
A、B、C、D、E均为有机化合物,A是分子式为C5H10O的直链化合物,B与NaHCO3溶液完全反应,其物质的量之比为1:2,它们之间的关系如图所示(提示:RCH=CHR′在酸性高锰酸钾溶液中反应生成RCOOH和R′COOH,其中R和R′为烷基).下列叙述错误的是( )
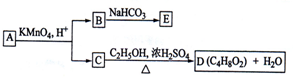

| A、B的结构简式为HOOC-CH2-COOH | B、C与乙醇发生了酯化反应 | C、A可以与氢氧化钠溶液发生中和反应 | D、E的分子式为C3H2O4Na2 |