题目内容
【题目】50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
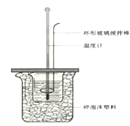
(1)环形玻璃搅拌棒_____(填能或不能)改为环形金属棒。其原因是________。
(2)大烧杯内填满碎泡沫塑料的作用______。
(3)实验中将氢氧化钠溶液分多次加入盐酸中,对求得中和热数值的影响是________(偏高或偏低或无影响)。
(4)如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放出的热量_______(增加、减少或不变),所求中和热数值____(增加、 减少或 不变)。
【答案】不能 因金属易导热 减少实验过程中的热量损失 偏低 增加 不变
【解析】
(1)环形金属棒是热的良导体,会使热量损失;
(2)中和热测定实验成败的关键是保温工作;
(3)分多次把NaOH溶液倒入盛有HCl的烧杯中,热量损失较大;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答。
(1)金属容易导热使热量损失,导致中和热测定不准确,因此不能使用金属棒;
(2)中和热测定实验成败的关键是保温工作,根据量热计的构造和实验的成败关键来判断该装置的大小烧杯间填满碎泡沫塑料的作用是保温、隔热,减少热量散失;
(3)尽量一次快速将NaOH溶液倒入盛有盐酸的烧杯中,不允许分多次把NaOH溶液倒入盛有盐酸的小烧杯中,否则会导致热量损失较多,影响中和热的测定,导致中和热数值偏低;
(4)反应放出的热量和所用酸以及碱的量的多少有关,若改用60mL 1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液进行反应,与上述实验相比,反应生成水的物质的量增多,所放出的热量增加,但是由于中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关,所以中和热不变。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案