题目内容
根据电解质和离子反应的相关知识回答以下问题:
(1)下列物质属于电解质的有 .
①Cu ②H2SO4 ③NaOH ④NaCl ⑤CaO ⑥CO2 ⑦CaCO3 ⑧H2
(2)除杂,括号中为杂质
NaCl(Na2CO3)试剂 ,离子方程式 .
Fe2O3(Al2O3)试剂 ,离子方程式 .
(1)下列物质属于电解质的有
①Cu ②H2SO4 ③NaOH ④NaCl ⑤CaO ⑥CO2 ⑦CaCO3 ⑧H2
(2)除杂,括号中为杂质
NaCl(Na2CO3)试剂
Fe2O3(Al2O3)试剂
考点:电解质与非电解质,物质的分离、提纯和除杂
专题:电离平衡与溶液的pH专题,化学实验基本操作
分析:(1)水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质;在上述两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质.大多数的有机物都是非电解质;单质,混合物既不是电解质也不是非电解质.
(2)可以根据物质的性质方面进行分析、判断,解答原则是原物质质量不能减少,在除去杂质的同时不能引入新的杂质.
(2)可以根据物质的性质方面进行分析、判断,解答原则是原物质质量不能减少,在除去杂质的同时不能引入新的杂质.
解答:
解:(1)①Cu为单质,既不是电解质也不是非电解质.
②H2SO4能电离出H+和SO42-在水溶液中能导电,属于电解质,
③NaOH为离子化合物,在水溶液中或熔融状态下能导电,属于电解质,
④NaCl为离子化合物,在水溶液中或熔融状态下能导电,属于电解质,
⑤CaO为离子化合物,在水溶液中或熔融状态下能导电,属于电解质,
⑥CO2 和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子而导电,但电离出离子的物质是碳酸不是CO2,所以CO2是非电解质,
⑦CaCO3是盐,在水溶液中虽难溶,但溶于水的部分或熔化状态下都能完全电离,CaCO3═Ca2++CO32-有自由移动的离子,能导电,属于电解质;
⑧H2为单质,既不是电解质也不是非电解质.
故选②③④⑤⑦;
(2)碳酸钠可以溶解在盐酸中,生成氯化钠、水以及二氧化碳气体,即2H++CO32-=CO2↑+H2O,可以用盐酸将氯化钠中的碳酸钠除去,故答案为:稀盐酸;2H++CO32-=CO2↑+H2O;
Fe2O3不与氢氧化钠溶液反应,而Al2O3能和氢氧化钠溶液反应:Al2O3+2OH-═2AlO2-+H2O,可以用氢氧化钠溶液将Fe2O3中的Al2O3除去,故答案为:氢氧化钠溶液;Al2O3+2OH-═2AlO2-+H2O;
②H2SO4能电离出H+和SO42-在水溶液中能导电,属于电解质,
③NaOH为离子化合物,在水溶液中或熔融状态下能导电,属于电解质,
④NaCl为离子化合物,在水溶液中或熔融状态下能导电,属于电解质,
⑤CaO为离子化合物,在水溶液中或熔融状态下能导电,属于电解质,
⑥CO2 和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子而导电,但电离出离子的物质是碳酸不是CO2,所以CO2是非电解质,
⑦CaCO3是盐,在水溶液中虽难溶,但溶于水的部分或熔化状态下都能完全电离,CaCO3═Ca2++CO32-有自由移动的离子,能导电,属于电解质;
⑧H2为单质,既不是电解质也不是非电解质.
故选②③④⑤⑦;
(2)碳酸钠可以溶解在盐酸中,生成氯化钠、水以及二氧化碳气体,即2H++CO32-=CO2↑+H2O,可以用盐酸将氯化钠中的碳酸钠除去,故答案为:稀盐酸;2H++CO32-=CO2↑+H2O;
Fe2O3不与氢氧化钠溶液反应,而Al2O3能和氢氧化钠溶液反应:Al2O3+2OH-═2AlO2-+H2O,可以用氢氧化钠溶液将Fe2O3中的Al2O3除去,故答案为:氢氧化钠溶液;Al2O3+2OH-═2AlO2-+H2O;
点评:本题考查电解质、非电解质概念的理解分析、物质的分离、提纯和除杂等问题,题目难度不大,需要注意的是除杂时不能引入新的杂质、不能影响被提纯的物质的性质和量,并且操作简单可行,除杂时要结合物质的物理性质和化学性质进行分离.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942KJ热量,根据以上信息判断,下列说法正确的是( )
意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942KJ热量,根据以上信息判断,下列说法正确的是( )| A、1mol N4转变成N2将放出882kJ热量 |
| B、N4属于一种新型的化合物 |
| C、N2与N4互为同分异构体 |
| D、N4是由极性键组成的分子 |
关于如图所示装置的叙述,正确的是( )


| A、铜是负极,铜片上有气泡产生 |
| B、铜片质量没有变化 |
| C、电流从锌片经导线流向铜片 |
| D、氢离子在铜片表面被氧化 |
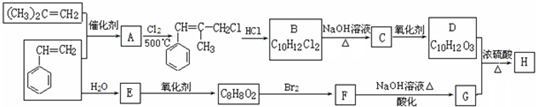
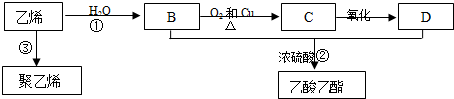
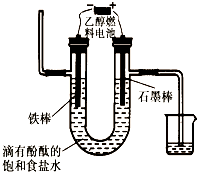 据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实.
据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实.