题目内容
(12分)、煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g)+H2O(g)
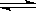 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
830 |
1000 |
|
平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题
(1)该反应的化学平衡常数表达式为K= 。
(2)上述正向反应是: 反应(选填:放热、吸热)。
(3)某温度下上述反应平衡时,恒容、升高温度,原化学平衡向
反应方向移动(填“正”或“逆”),
正反应速率 (填“增大”、“减小”或“不变”),
容器内混合气体的压强 (填“增大”、“减小”或“不变”)。
(4)在830℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D)。
|
|
A |
B |
C |
D |
|
n(CO2) |
3 |
1 |
0 |
1 |
|
n(H2) |
2 |
1 |
0 |
1 |
|
n(CO) |
1 |
2 |
3 |
0.5 |
|
n(H2O) |
5 |
2 |
3 |
2 |
【答案】
(1)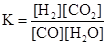 (2)放热
(3)逆 增大 增大 (4)B、C
(2)放热
(3)逆 增大 增大 (4)B、C
【解析】(1)平衡常数是指当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂
之积的比值,所以该反应的平衡常数表达式为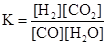
(2)随着温度的升高,平衡常数逐渐减小,说明升高温度,平衡向逆反应方向移动,所以正反应是放热反应。
(3)升高温度,平衡向逆反应方向移动,反应速率均是增大。由于反应前后体积不变,所以气体的物质的量不变,但温度升高,压强增大。
(4)j将ABCD中的有关数据分别代入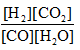 ,所的值分别是1.2、0.25、0、1,所以选项A向逆反应方向移动,BC向正反应方向移动,D恰好是平衡状态。
,所的值分别是1.2、0.25、0、1,所以选项A向逆反应方向移动,BC向正反应方向移动,D恰好是平衡状态。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2012?湖南一模)低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.
(2012?湖南一模)低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题. H2(g)+CO2(g)的平衡常数随温度的变化如表:
H2(g)+CO2(g)的平衡常数随温度的变化如表: 2CO(g)平衡常数K;
2CO(g)平衡常数K; CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1; H2(g)+CO2(g) 平衡常数K2,
H2(g)+CO2(g) 平衡常数K2,