题目内容
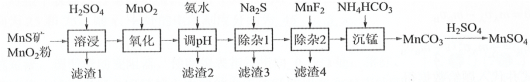
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和___;在稀硫酸“溶浸”中二氧化锰与硫化锰发生氧化还原反应,还原剂是__,写出化学方程式___。
(2)“氧化”中添加适量的MnO2的作用是__。
(3)“调pH”除铁和铝,溶液的pH范围应调节为__~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是__。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是__。
(6)写出“沉锰”的离子方程式__。
(7)工业上常用NH4HCO3做金属离子的沉淀剂,而不用Na2CO3或NaHCO3,其优点是NH4HCO3溶解度大,容易洗涤,过量时受热易分解,便于分离除去。写出分解的化学方程式__
【答案】SiO2(不溶性硅酸盐) MnS MnO2+MnS+2H2SO4=2MnSO4+S+2H2O 将Fe2+氧化为Fe3+ 4.7 NiS和ZnS F-与H+结合形成弱电解质HF,MgF2![]() Mg2++2F-平衡向右移动 Mn2++2HCO3-=MnCO3↓+CO2↑+H2O NH4HCO3
Mg2++2F-平衡向右移动 Mn2++2HCO3-=MnCO3↓+CO2↑+H2O NH4HCO3![]() NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
【解析】
根据流程:二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)在硫酸中酸浸,主要的反应为:MnO2+MnS+2H2SO4=2MnSO4+S+2H2O,SiO2不溶于硫酸,过滤,滤渣1含有S和SiO2,滤液含有Mn2+、Fe2+、Fe3+、Al3+、Mg2+、Zn2+、Ni2+,加入MnO2将Fe2+氧化为Fe3+,加入氨水调节pH在4.7~6之间,除去Fe3+、Al3+,滤渣2为Fe(OH)3、Al(OH)3,滤液中加入Na2S除去Zn2+和Ni2+,“滤渣3”的主要成分是NiS和ZnS,加入MnF2生成MgF2沉淀除去Mg2+,滤渣4为MgF2,滤液主要含有Mn2+,加入碳酸氢铵发生反应:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,用硫酸溶解碳酸锰得到产品硫酸锰,据此分析作答。
(1)Si元素以SiO2(不溶性硅酸盐)的形式存在,SiO2(不溶性硅酸盐)不溶于硫酸,“溶浸”中二氧化锰与硫化锰反应为:MnO2+MnS+2H2SO4=2MnSO4+S+2H2O,MnS为还原剂,滤渣1含有S和SiO2(不溶性硅酸盐);
故答案为:SiO2(不溶性硅酸盐);MnS ;MnO2+MnS+2H2SO4=2MnSO4+S+2H2O;
(2)“氧化”中添加适量的MnO2的作用是将Fe2+氧化为Fe3+;故答案为:将Fe2+氧化为Fe3+;
(3)根据分析,调节pH的目的是除去Fe3+、Al3+,但不沉淀Mn2+、Mg2+、Zn2+、Ni2+,根据表pH的范围为4.7~6;故答案为:4.7;
(4)加入Na2S除去Zn2+和Ni2+,“滤渣3”的主要成分是NiS和ZnS;故答案为:NiS和ZnS;
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+,若溶液酸度过高,Mg2+沉淀不完全,因为F与H+结合形成弱电解质HF,MgF2Mg2++2F平衡向右移动;故答案为:F与H+结合形成弱电解质HF,MgF2Mg2++2F平衡向右移动;
(6)根据分析和流程,沉锰的反应为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;故答案为:Mn2++2HCO3-=
(7)NH4HCO3分解的化学方程式为:NH4HCO3![]() NH3↑+CO2↑+H2O;故答案为:NH4HCO3
NH3↑+CO2↑+H2O;故答案为:NH4HCO3![]() NH3↑+CO2↑+H2O。
NH3↑+CO2↑+H2O。

【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100 mL溶液,向溶液中加入下列物质,有关结论正确的是( )
加入物质 | 结论 | |
A | 50 mL 1 mol·L-1H2SO4 | 反应结束后,c(Na+)=c(SO |
B | 0.05 mol CaO | 溶液中 |
C | 50 mL H2O | 由水电离出的c(H+)·c(OH-)不变 |
D | 0.1 mol NaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D