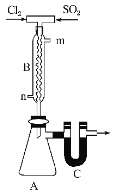
题目内容
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应I:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mo1-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mo1-1
反应Ⅱ:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) ![]() CH3OH(g) △H3=-90.77 kJ·mo1-1
CH3OH(g) △H3=-90.77 kJ·mo1-1
回答下列问题:
(1)反应Ⅱ的△H2=__________。
(2)反应Ⅲ能够自发进行的条件是__________(填“较低温度”、“较高温度”或“任何温度”)。
(3)恒温,恒容密闭容器中,对于反应I,下列说法中能说明该反应达到化学平衡状态的是__________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1︰3︰1︰1
D.甲醇的百分含量不再变化
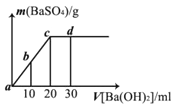
(4)对于反应I,温度对CO2的转化率及催化剂的效率影响如图所示:

①下列有关说法不正确的是_______________
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
②若在1L密闭容器中充入3molH2和1 molCO2发生反应I,250℃时反应的平衡常数K=__________(保留3位小数);若要进一步提高甲醇体积分数,可采取的措施有__________。
【答案】+41.19 kJ·mo1-1 较低温度 BD ABD 0.148 增大压强(降低温度)
【解析】
(1)根据盖斯定律:Ⅱ=I-Ⅲ得反应Ⅱ的△H2。
(2)△G=△H-T△S<0时,反应能够自发进行,该反应的△S<0,△H<0,当温度较低时,反应Ⅲ能够自发进行。
(3)A. 由于气体的质量、体积不变,则无论是否达到平衡状态,混合气体的密度都不变化,不能作为判断是否平衡的依据。
B. 反应前后气体的物质的量不等,混合气体的平均相对分子质量不再变化,可说明气体的物质的量不再变化,说明达到平衡状态。
C. 平衡常数未知,CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1 ,不能判断是否达到平衡状态。
D. 甲醇的百分含量不再变化,可说明达到平衡状态。
(4)①反应I:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mo1-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mo1-1
A.由图像可知,其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率一定位于M。
B.温度低于250℃时,随温度升高二氧化碳转化量降低,甲醇的产率减小。
C.平衡常数只与温度有关,M点温度低于N点温度,温度高,平衡逆向移动,则M点时平衡常数比N点时平衡常数大。
D.根据图像可知,催化剂催化效率在250℃左右最高,实际反应应控制温度在250℃左右。
②根据三段式计算。
(1)反应I:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mo1-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mo1-1
反应Ⅱ:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) ![]() CH3OH(g) △H3=-90.77 kJ·mo1-1
CH3OH(g) △H3=-90.77 kJ·mo1-1
根据盖斯定律:Ⅱ=I-Ⅲ得反应Ⅱ的△H2=+41.19 kJ·mo1-1,故答案为:+41.19 kJ·mo1-1。
(2)△G=△H-T△S<0时,反应能够自发进行,该反应的△S<0,△H<0,当温度较低时,反应Ⅲ能够自发进行,故答案为:较低温度。
(3)A. 由于气体的质量、体积不变,则无论是否达到平衡状态,混合气体的密度都不变化,不能作为判断是否平衡的依据,故A错误;
B. 反应前后气体的物质的量不等,混合气体的平均相对分子质量不再变化,可说明气体的物质的量不再变化,说明达到平衡状态,故B正确;
C. 平衡常数未知,CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1 ,不能判断是否达到平衡状态,故C错误;
D. 甲醇的百分含量不再变化,可说明达到平衡状态,故D正确。
故选BD。
(4)①反应I:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mo1-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mo1-1
A.由图像可知,其他条件不变,若不使用催化剂,不会改变平衡状态,二氧化硫的平衡转化率不变,则250℃时CO2的平衡转化率一定位于M,故A错误;
B.温度低于250℃时,随温度升高二氧化碳转化量降低,甲醇的产率减小,故B错误;
C.平衡常数只与温度有关,由于该反应正反应方向是放热反应,M点温度低于N点温度,温度升高,平衡逆向移动,则M点时平衡常数比N点时平衡常数大,故C正确;
D.根据图像可知,催化剂催化效率在250℃左右最高,实际反应应控制温度在250℃左右,故D错误;
故选ABD。
② M点二氧化碳的转化率是50%,
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mo1-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mo1-1
起始量(mol) 1 3 0 0
变化量(mol)0.5 1.5 0.5 0.5
平衡量(mol)0.5 1.5 0.5 0.5
体积为1L,K=0.5×0.5/0.5×1.53=0.148,反应后气体体积减小,若要进一步提高甲醇体积分数,可采取的措施有增大压强或降低温度,平衡正向移动,故答案为:0.148;增大压强(降低温度)。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】将气体A、B置于固定容积为4L的密闭容器中,发生如下反应:2A(g)+B(g)![]() C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
(1)用生成物C表示20s内的平均反应速率为_________________mol/(L·s)。
(2)反应前A的物质的量浓度是________________mol/L。
(3)反应达平衡时,B的转化率为________________ 。
(4)若改变下列条件,D的生成速率如何变化(用“增大”或“减小”或“不变”填空)。
编号 | 改变的条件 | D的生成速率 |
① | 降低体系温度 | ______ |
② | 恒容下补充A气体 | ______ |
③ | 恒容下充入Ne(不参与体系反应) | ______ |