题目内容
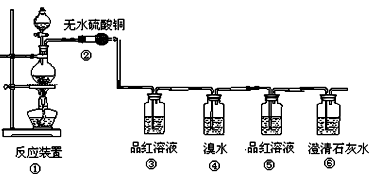
(本小题满分14分)某研究性学习小组欲验证红热的炭与浓硫酸发生反应所生成的各种产物,按气体的流动方向设计了如下实验流程:
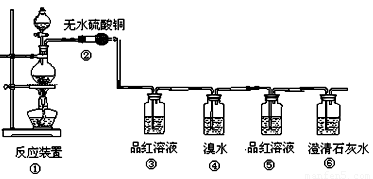
(1)①中反应的化学方程式为 ;
(2)②处的现象是: 。
(3)品红溶液使用了两次,第一次使用时的作用是
第二次使用时的作用是________________ _。
(4)二氧化硫也能使溴水褪色,表现了二氧化硫的 性。(“还原”、“漂白”)
反应的化学方程式为: 。
(5)根据 现象,可证明产物中一定有CO2气体
(1)C
+ 2H2SO4(浓) 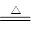 CO2↑+ 2SO2↑+ 2H2O
CO2↑+ 2SO2↑+ 2H2O
(2)白色固体变蓝色
(3)检验是否有SO2生成; 检验SO2是否除净
(4)还原; SO2 + Br2 + 2H2O == H2SO4 + 2HBr
(5)⑤中品红溶液不褪色,⑥中澄清石灰水变混浊。
【解析】(1)浓硫酸具有强氧化性,在加热时可以和碳反应生成CO2和SO2气体以及水蒸气。
(2)生成的水遇到无色硫酸铜会生成胆矾,而显蓝色。
(3)SO2具有漂泊性,能使品红溶液褪色,所以可用品红来检验SO2的存在。因为SO2也能使澄清的石灰水变混浊,所以在检验CO2之前需要首先除去SO2。为了检验SO2是否完全被吸收,需要再一次通过品红溶液。
(4)因为SO2具有还原性,溴水具有氧化性,所以可用溴水来吸收SO2。
(5)只有⑤中的品红溶液不再褪色,才能证明SO2已经完全被吸收,如果此时澄清的石灰水变混浊,则可以说明一定有CO2生成。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案(本小题满分14分)a、b、c、d、e四种短周期元素的原子序数逐渐增大。a为非金属元素,且a、e同主族,c、d为同周期的相邻元素。e原子的质子数等于c、d原子最外层电子数之和。b原子最外层电子数是内层电子数的2倍。c的氢化物分子中有3个共价键。试推断:
(1)写出b元素在周期表中的位置 ;
(2)有a、c、d所形成的离子化合物是 它与e的最高价氧化物对应水化物的溶液加热时反应的离子方程式是 ;
(3)c的单质的电子式为 。
(4)b和d相比,非金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是 (选填字母序号)。
| A.常温下,b的单质呈固态,d的单质呈气态 |
| B.d的氢化物的稳定性强于b的氢化物 |
| C.b与d形成的化合物中,b呈正价 |
| D.d的氢化物的沸点高于b的氢化物 |