��Ŀ����
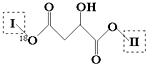
����Ŀ��ij��ɫũҩ�ṹ��ʽΪͼ1���ش��������⡣
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ______________����ũҩ���Ԫ���У���һ�����ܽϴ��ǰ����Ԫ����______________(���ɴ�С��������)��
��2�������б��Ϊ�ٵ�̼ԭ�Ӻ�����ɼ������⼸��ԭ�ӹ��ɵĿռ�ṹΪ____________��CSe2�״�����H2Se ��CCl4; ��Ӧ��ȡ�ģ��ԱȽ��������ַ��ӵļ���_____________(������С˳������)��
��3��H2SeO3 ���ӵ�����ԭ���ӻ�������____________���ԱȽ�H2SeO3��H2SeO4 ��H2SO4�����������ǿ��(����ǿ����˳������)_______________��
��4��ʯī��̼Ԫ�ص�һ��ͬ�������壬ʯī����ɿ���ABABA...�ѻ���ʽ�������ṹ�Ͳ��־���������ͼ2 ��ʾ; ��������ӿ������ʯī�����γ�ʯī�в㻯���ͬʱ�ѻ���ʽ��ABABAB...��ΪAAAA...��
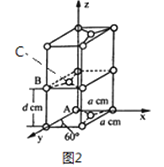
��ԭ����������������Ǿ�����ԭ�Ӽ�����λ�á�ʯī������̼ԭ��A��B ����������ֱ�Ϊ: A��0��0��0)��B(0��1��1/2)����C ԭ�ӵ��������Ϊ_____________����
�ھ���������������Ʒ���Ĵ�С����״����֪ʯī�����ױ߳�Ϊa pm������Ϊd pm�������ӵ�������ֵΪNA����ʯī���ܶ�Ϊ_____________g/cm3 (д������ʽ����)��
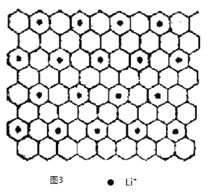
��ͼ3Ϊʯī�в㻯����W ��ͶӰͼ����д��W �Ļ�ѧʽ_____________����֮����ڵĻ�ѧ����_____________��
���𰸡� [Ar] 3d104s24p4 F>N>O �������� Cse2> CCl4> H2Se sp3��sp3 H2SO4> H2SeO4> H2SeO3 (1/3��2/3��1/2) 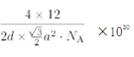 C8Li ���Ӽ����ۼ�
C8Li ���Ӽ����ۼ�
��������������Ҫ�������ʽṹ��
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ[Ar]3d104s24p4����ũҩ���Ԫ���У���һ�����ܽϴ��ǰ����Ԫ����F��C��N��һ��ǽ�����Խǿ����һ������Խ�ǽ����ԣ�F>O>N���������ڵ�ԭ���������Ӵ��ڰ�����Ľ��ȶ�״̬��ʹ�õ��ĵ�һ�����ܴ����������Ե�һ�����ܣ�F>N>O��
��2�������б��Ϊ�ٵ�̼ԭ�Ӻ�����ɼ������⼸��ԭ���γɵ��������ɵĿռ�ṹΪ����������CSe2��CO2�ǵȵ����壬CSe2��ֱ���η��ӣ�������120����H2Se��H2O�ǵȵ����壬H2Se�ļ���С��109.5�㣬CCl4�����������η��ӣ�������109.5�㣬�����������ַ��ӵļ���Cse2>CCl4>H2Se��
��3��H2SeO3�����������ǻ�������ԭ�Ӽ۲���Ӷ�Ϊ4���ӻ�������sp3��H2SeO3��H2SeO4��H2SO4������ķ��ǻ���ԭ�����ֱ���1��2��2���ǽ����ԣ�S>Se������������H2SO4>H2SeO4>H2SeO3��
��4����ʯī������̼ԭ��A��B ����������ֱ�Ϊ: A��0��0��0)��B(0��1��1/2)����Cԭ�ӵ��������Ϊ(1/3��2/3��1/2)��
��ʯī������Ԫ��ƽ������2��̼ԭ�ӣ������Ϊ![]() a2pm2���������Ϊd��
a2pm2���������Ϊd��![]() a2pm3����ʯī���ܶ�Ϊ
a2pm3����ʯī���ܶ�Ϊ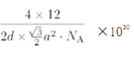 g/cm3(д������ʽ����)��
g/cm3(д������ʽ����)��
��ƽ��ÿ4����Ԫ������1��Li+��ÿ����Ԫ��ƽ������2��̼ԭ�ӣ�����W�Ļ�ѧʽΪC8Li����֮����ڵĻ�ѧ���н���ԭ����ǽ���ԭ��֮���γɵ����Ӽ��ͷǽ���ԭ��֮��Ĺ��ۼ���

����Ŀ����80��ʱ����0.40mol��N2O4�������2L�Ѿ���յĹ̶��ݻ����ܱ������У��������·�Ӧ��N2O42NO2 �� ��һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
ʱ��/s | 0 | 20 | 40 | 60 | 80 | 100 |
n��N2O4�� | 0.40 | a | 0.20 | c | d | e |
n��NO2�� | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
��1������20��40s����N2O4��ʾ��ƽ����Ӧ����ΪmolL��1s��1 ��
��2��������80��ʱ�÷�Ӧ��ƽ�ⳣ��K= ��
��3����Ӧ������100s��Ӧ�������¶Ƚ��ͣ�����������ɫ�����dz������������䡱����
��4��Ҫ����÷�Ӧ��Kֵ���ɲ�ȡ�Ĵ�ʩ��������ĸ����
a������N2O4��ʼŨ��
b������������ͨ��NO2
c��ʹ�ø�Ч����
d�������¶ȣ�