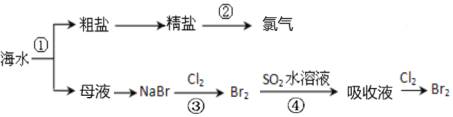
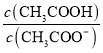题目内容
【题目】(1)12.4g Na2R含Na+ 0.4mol,则Na2R的摩尔质量为________________。
(2)在标准状况下,50g CO和CO2的混合气体的体积为33.6L,则两种气体的物质的量之比为___________。
(3)浓度为36.5%的浓盐酸,其密度为1.19g/cm3,则该盐酸的物质的量浓度为___________。
(4)若20g密度为pg.mL-1的Ca(NO3)2溶液中含有2g Ca(NO3)2,则溶液中NO3-的物质的量浓度为_________。
(5)已知在碱性溶液中可发生如下反应:2R(OH)3+3C1O-+40H-=2RO4n-+3C1-+5H2O,则RO4n-中R的化合价是___________。
【答案】64g/mol 2:1 11.9mol/L ![]() mol/L +6
mol/L +6
【解析】
(1)12.4g Na2R含Na+ 0.4mol,则Na2R的摩尔质量为 = 64g·mol-1。
= 64g·mol-1。
(2)标准状况下,Vm=22.4L·mol-1,n=V÷Vm=33.6L÷22.4L·mol-1=1.5mol,
设CO的物质的量为x,CO2的物质的量为y,
则有:x+y=1.5 28x+44y=50
解之得:x=1mol,y=0.5mol,两种气体的物质的量之比=1:0.5=2:1;
(3)此浓盐酸的物质的量浓度为:c(HCl)=![]() mol·L-1=11.9mol·L-1
mol·L-1=11.9mol·L-1
(4)该硝酸钙溶液中溶质的质量分数为:2g÷20g×100%=10%,
则该溶液中硝酸钙的物质的量浓度为:c=![]() mol·L-1,
mol·L-1,
所以溶液中NO3-的物质的量浓度为:c(NO3-)=2c[Ca(NO3)2]=![]() mol·L-1×2=
mol·L-1×2=![]() mol·L-1;
mol·L-1;
(5)根据电荷守恒得3×1+4×1=3×1+2n,则n=2,所以RO4n-为RO42-,该离子中O元素化合价为-2价,R、O元素化合价的代数和为-2,所以该离子中R元素化合价=-2-(-2)×4=+6。

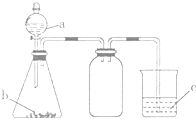
【题目】利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )
试剂a | 试剂b | 试剂c | 实验目的 |
| |
① | 盐溶液X | NaOH | 酚酞 | 证明X中含有NH4+ | |
② | 浓盐酸 | CaCO3 | Na2SiO3溶液 | 证明酸性: HCl>H2CO3>H2SiO3 | |
③ | 浓盐酸 | MnO2 | 淀粉KI溶液 | 证明氧化性:MnO2>Cl2>I2 | |
④ | 浓硫酸 | C | 澄清石灰水 | 证明产物中含有CO2 |
A.①②③B.①③C.②③D.①②③④