题目内容
【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是____。
(2)用标准的NaOH溶液滴定待测的盐酸时,左手握_______(填“酸式”或“碱式”)滴定管的活塞,右手摇动锥形瓶,眼睛注视_______________判断滴定终点的现象是____________________。
(3)若测定结果偏高,其原因可能是_____。
a.配制标准溶液的固体NaOH中混有KOH杂质
b.滴定终点读数时,仰视滴定管的刻度,其他操作正确
c.盛装待测液的锥形瓶用蒸馏水洗过后未用待测液润洗
d.滴定管滴定前无气泡,滴定后有气泡
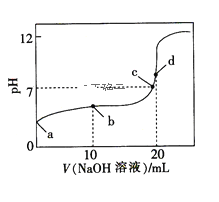
(4)如图是某次滴定时的滴定管中的液面,其读数为_____mL。
![]()
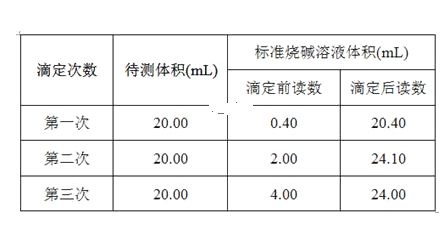
(5)根据下列数据,请计算待测盐酸的浓度:_________mol·L-1。
【答案】① 碱式 锥形瓶中的溶液颜色变化 滴入最后一滴NaOH溶液时,溶液刚好由无色变为浅红色,且半分钟内不褪色 ab 22.60 0.200 0
【解析】
(1)根据碱式滴定管在装液前应用所装液体进行润洗;
(2)滴定时标准NaOH应装在碱式滴定管中,眼睛注视锥形瓶内溶液颜色变化,滴定终点时溶液颜色由无色突变为红色,且半分钟内不褪色;
(3)根据![]() 分析不当操作对V(标准)×的影响,以此判断浓度的误差;
分析不当操作对V(标准)×的影响,以此判断浓度的误差;
(4)根据滴定管的结构小数在上、大数在下和精确度为0.01mL解答;
(5)分析表中数据有效性,依据![]() 计算待测液浓度。
计算待测液浓度。
(1)根据碱式滴定管在装液前应用所装液体进行润洗,用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上是错误的,
故答案为:①
(2)滴定时标准NaOH应装在碱式滴定管中,滴定时左手握滴定管,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色变化,强碱滴定强酸时达到终点时无色变为浅红色,且半分钟内不褪色,
故答案为:碱式 ; 锥形瓶中的溶液颜色变化; 滴入最后一滴NaOH溶液时,溶液刚好由无色变为浅红色,且半分钟内不褪色;
(3)a.配制标准溶液的固体NaOH中混有KOH杂质,标准溶液中氢氧根离子的浓度偏小,消耗的V(标准)增大,测定结果偏高,故a正确;
b.滴定终点读数时,仰视滴定管的刻度,读取消耗的V(标准)偏大,测定结果偏高,故b正确;
c.盛装待测液的锥形瓶用蒸馏水洗过后未用待测液润洗,测定结果不受影响,故c错误;
d.滴定管滴定前无气泡,滴定后有气泡V(标准)偏小,测定结果偏低,故d错误
故答案选ab。
(4)依据滴定管构造及精确度可知图中液面读数为:22.60;
故答案为:22.60;
(5)三次消耗标准液体积分别为:20.00,22.10,20.00,第二组数据误差较大,应舍弃,则消耗标准液平均体积为:20.00mL,待测液浓度为: 0.2000 mol·L-1×20.00ml÷20.00ml=0.200 0 mol·L-1,
故答案为:0.2000。

【题目】几种短周期元素的原子半径及主要化合价如表:
元素代号 | X | Y | Z | W | Q |
原子半径 | 160 | 143 | 70 | 66 | 104 |
主要化合价 |
|
|
|
|
|
下列选项正确的是( )
A.X、Y元素的金属性![]()
B.一定条件下,Z单质与W的常见单质直接生成![]()
C.Y的最高价氧化物对应的水化物能溶于氨水
D.Q与W形成的一种化合物可用作纸张漂白剂
【题目】4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性.![]() 称为拟卤素,性质与卤素相似.下列说法不正确的是( )
称为拟卤素,性质与卤素相似.下列说法不正确的是( )
M | N | ||
X | Y |
A.X位于三周期IIA,其单质可采用电解熔融![]() 制备
制备
B.元素最高价氧化物的水化物中,酸性最强的是![]()
C.气体分子![]() 的电子式为
的电子式为![]()
D.![]() 其与氢氧化钠溶液反应的化学方程式为
其与氢氧化钠溶液反应的化学方程式为![]()