题目内容
12.红热的铁与水蒸气可发生反应:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2,其中铁被氧化(填“氧化”或“还原”),H2O作氧化剂(填“氧化”或“还原”)剂.在该反应中,若消耗了3mol Fe,转移电子的物质的量是8 mol.分析 反应3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2中,Fe元素化合价升高,被氧化,H元素化合价降低,被还原,H2O为氧化剂,结合反应的方程式计算相关物质的物质的量.
解答 解:反应3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2中,Fe元素化合价升高,被氧化,H元素化合价降低,被还原,H2O为氧化剂,若消耗了3molFe,由方程式可知有4molH2生成,转移8mol电子;
故答案为:氧化;氧化剂;8 mol.
点评 本题考查氧化还原反应、硅酸盐,题目难度不大,注意把握元素化合价的变化,结合反应的方程式进行计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.许多国家十分重视海水资源的综合利用,不需要化学变化就能够从海水中获得的物质是( )
| A. | 食盐 | B. | 镁 | C. | 氢气 | D. | 淡水 |
3.胶体区别于其他分散系的本质特征是( )
| A. | 产生布朗运动 | B. | 产生丁达尔现象 | ||
| C. | 胶体微粒不能穿透半透膜 | D. | 分散质直径在10-7~10-9m之间 |
20.下列物品用到硅单质的是( )
| A. | 手机芯片 | B. | 光导纤维 | C. | 陶瓷餐具 | D. | 石英钟表 |
7.下列物质间的转化,需要加入氧化剂才能实现的是( )
| A. | Cl2→HClO | B. | Fe2O3→Fe | C. | NH3→NO | D. | H2SO4(浓)→SO2 |
17.在“空气质量日报”中,不被列入首要污染物的是( )
| A. | 二氧化硫 | B. | 氮氧化物 | C. | 可吸入颗粒物 | D. | 二氧化碳 |
4.有关①100mL 0.1mol/L NaHCO3、②100mL 0.1mol/L Na2CO3两种溶液的叙述不正确的是( )
| A. | 溶液中水电离出的H+个数:②>① | |
| B. | Na2CO3溶液中:c(Na+)=2c(CO32-)+c(H2CO3)+c(HCO3-) | |
| C. | ①溶液中:c(CO${\;}_{3}^{2-}$)<c(H2CO3) | |
| D. | ②溶液中:c(HCO${\;}_{3}^{-}$)>c(H2CO3) |
14.下列离子在溶液中能大量共存的是( )
| A. | H+、A1O2-、Na+、Cl- | B. | 强碱性溶液:Na+、HCO3-、SO42- | ||
| C. | Fe2+、Fe3+、Na+、NO3- | D. | Fe2+、NH4+、Cl-、OH- |
 ;
;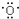 ;
;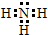 ,结构式为
,结构式为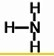 .
.