题目内容
【题目】如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8。工作时,需先引发铁和氯酸钾反应使共晶盐融化。已知:Li熔点181℃,LiCl-KCl共晶盐熔点352℃.下列说法正确的是( )
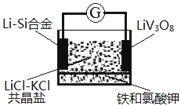
A. 整个过程的能量转化只涉及化学能转化为电能
B. 放电时LiV3O8一极反应为:Li1+xV3O8-xe═LiV3O8+xLi+
C. 外电路中有NA个电子发生转移时,有7.0gLi+移向Li-Si合金一极
D. Li-Si合金熔点高于352℃
【答案】D
【解析】整个过程的能量转化涉及化学能转化为电能以及化学能和热能之间的转化,故A错误;放电时正极得电子发生还原反应,即正极反应式为LiV3O8+xLi++xe-═Li1+xV3O8,故B错误;放电时阳离子移向正极,Li+移向LiV3O8一极,故C错误;根据工作时,需先引发铁和氯酸钾反应使共晶盐融化,温度高于352℃,所以Li-Si合金熔点高于352℃,故D正确。

【题目】I.下列是A、B、C、D、E五种短周期元素的某些性质:
性质 | A | B | C | D | E |
化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
(1)元素A是形成有机物的主要元素,下列分子中存在sp和sp3杂化方式的是____(填序号)。
a.![]() b.CH4 c.CH2
b.CH4 c.CH2![]() CHCH3d.CH3CH2C≡CH e.CH3CH3
CHCH3d.CH3CH2C≡CH e.CH3CH3
(2)相同条件下,AD2与BD2分子在水中的溶解度较大的是_______(写化学式)
(3)B、D形成的简单氢化物,沸点:_______更高(写化学式)
II.乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用如图所示装置制备乙酸乙酯。

(1)若实验中用乙酸和乙醇反应,则该装置与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是_______。
(2)若现有乙酸90 g,乙醇138 g,发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为__。
(3)用如图所示的分离操作流程分离含乙酸、乙醇和水的乙酸乙酯粗产品,图中( )内为适当的试剂,[ ]内为适当的分离方法。

试剂a是____;分离方法③是____。
【题目】下表中物质的分类组合完全正确的是
编号 | A | B | C | D |
强电解质 | KNO3 | H2SO4 | BaSO4 | HClO4 |
弱电解质 | HClO4 | CaCO3 | HClO | NH3·H2O |
非电解质 | SO2 | CS2 | H2O | C2H5OH |
A. A B. B C. C D. D

