题目内容
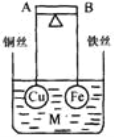
【题目】(1)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图是高铁电池的模拟实验装置:

①该电池放电时正极的电极反应式为_______________________________________;若维持电流强度为1 A,电池工作十分钟,理论上消耗Zn______ g(计算结果保留一位小数,已知F=96500 C·mol-1)。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向______(填“左”或“右”)移动;若用阳离子交换膜代替盐桥,则钾离子向________(填“左”或“右”)移动。
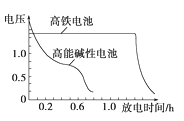
③下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有__________。
(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是__________________________,A是________。

(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示。该电池中O2-可以在固体介质NASICON (固溶体)内自由移动,工作时O2-的移动方向________(填“从a到b”或“从b到a”),负极发生的电极反应式为__________________________。

【答案】FeO42—+4H2O+3e-=Fe(OH)3↓+5OH-0.2右左使用时间长、工作电压稳定N2+8H++6e-=2NH4+氯化铵(或NH4Cl)从b到aCO+O2--2e-=CO2
【解析】
(1) ①根据电池装置,锌做负极,碳为正极,高铁酸钾的氧化性很强,正极上高铁酸钾发生还原反应生成氢氧化铁,电极反应为 FeO42—+4H2O+3e-=Fe(OH)3↓+5OH-;若维持电离强度为1A,电池工作十分钟,通过的电子为![]() ,则理论消耗锌的质量为
,则理论消耗锌的质量为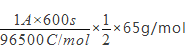 = 0.2g。②盐桥中阴离子向负极移动,盐桥起的作用是使两个半电池连成一个通路,使两溶液保持电中性,起到平衡电荷、构成闭合回路的作用,放电时盐桥中氯离子向右移动,用某种高分子材料制成阳离子交换膜代替盐桥,则钾离子向左移动。③由图可知高铁电池的优点有使用时间长、工作电压稳定。 (2)该电池的本质反应是合成氨的反应,电池中氢气失去电子,在负极上发生氧化反应,氮气得到电子在正极上发生还原反应,则正极反应为N2+8H++6e-=2NH4+,氨气和氯化氢反应生成氯化铵,则电解质溶液为氯化铵。(3)根据图可知,一氧化碳和空气形成燃料电池,一氧化碳失去电子和氧离子反应生成二氧化碳发生氧化反应,电极反应式为CO+O2--2e-=CO2,所以一氧化碳所在极为负极,通入空气的一极为正极,原电池放电时电子从负极流向正极,阴离子向负极移动,所以工作时氧离子的移动方向为从b到a。
= 0.2g。②盐桥中阴离子向负极移动,盐桥起的作用是使两个半电池连成一个通路,使两溶液保持电中性,起到平衡电荷、构成闭合回路的作用,放电时盐桥中氯离子向右移动,用某种高分子材料制成阳离子交换膜代替盐桥,则钾离子向左移动。③由图可知高铁电池的优点有使用时间长、工作电压稳定。 (2)该电池的本质反应是合成氨的反应,电池中氢气失去电子,在负极上发生氧化反应,氮气得到电子在正极上发生还原反应,则正极反应为N2+8H++6e-=2NH4+,氨气和氯化氢反应生成氯化铵,则电解质溶液为氯化铵。(3)根据图可知,一氧化碳和空气形成燃料电池,一氧化碳失去电子和氧离子反应生成二氧化碳发生氧化反应,电极反应式为CO+O2--2e-=CO2,所以一氧化碳所在极为负极,通入空气的一极为正极,原电池放电时电子从负极流向正极,阴离子向负极移动,所以工作时氧离子的移动方向为从b到a。

 阅读快车系列答案
阅读快车系列答案【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取 50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH 溶液,并用另一温度计测出其温度;③将 NaOH 溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
回答下列问题:
(1)倒入 NaOH 溶液的正确操作是_____(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与 NaOH 溶液混合均匀的正确操作是_____(填序号)。
A.用温度计小心搅拌 B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为 ΔH1、ΔH2、ΔH3,则 ΔH1、ΔH2、ΔH3 的大小关系为______________________。
(4)假设盐酸和氢氧化钠溶液的密度都是 1 g·cm-3,又知中和反应后生成溶液的比热容 c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
实验序号 | 起始温度 t1/ ℃ | 终止温度 t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热 ΔH=_____(结果保留一位小数)。_____(填“能”或“不能”)用 Ba(OH)2 溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_____。