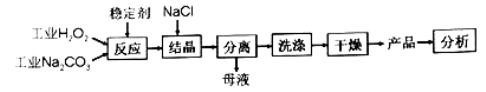
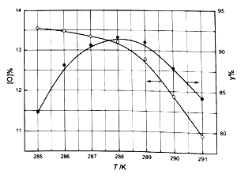
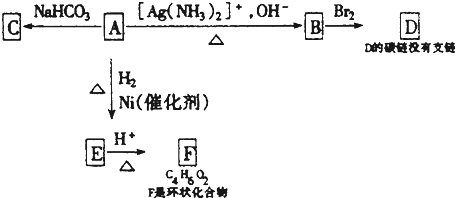
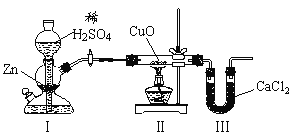
��Ŀ����
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A����100 mLŨ��Ϊ1 molL��1�� Fe��NO3��3����Һ��ͨ������SO2��2Fe3++SO2+2H2O�T2Fe2++SO42��+4H+
B����100 mLŨ��Ϊ2 molL��1��FeI2����Һ��ͨ���״����5.6 L��Cl2��4Fe2++6I��+5Cl2�T4Fe3++3I2+10Cl��
C����NaHCO3��Һ�м�������ij���ʯ��ˮ��2HCO3��+Ca2++2OH���TCaCO3��+2H2O+CO32��
D����������Һ�м������������������Һ��Al3++2SO42��+2Ba2++4OH���T2BaSO4��+AlO2��+2H2O
���𰸡�D
���������⣺A����100 mLŨ��Ϊ1 molL��1�� Fe��NO3��3����Һ��ͨ������SO2�����������Ҳ���뷴Ӧ����ȷ�����ӷ���ʽΪ��3NO3��+Fe3++5SO2+4H2O�TFe2++5SO42��+8H++3NO������A����
B����100 mLŨ��Ϊ2 molL��1��FeI2����Һ��ͨ���״����5.6 L��Cl2�����������ʵ���Ϊ��![]() =0.25mol���⻯���������ʵ���Ϊ0.2mol�������ӻ�ԭ�Դ����������ӣ�����������ȷ�Ӧ��0.4mol��������ȫ��Ӧ����0.2mol������˵������ǡ�÷�Ӧ����ȷ�ķ�ӦΪ��2I��+Cl2�TI2+2Cl������B����
=0.25mol���⻯���������ʵ���Ϊ0.2mol�������ӻ�ԭ�Դ����������ӣ�����������ȷ�Ӧ��0.4mol��������ȫ��Ӧ����0.2mol������˵������ǡ�÷�Ӧ����ȷ�ķ�ӦΪ��2I��+Cl2�TI2+2Cl������B����
C��NaHCO3��Һ�м�������ij���ʯ��ˮ����Ӧ����̼��Ƴ������������ƺ�ˮ����ȷ�����ӷ���ʽΪ��HCO3��+Ca2++OH���TCaCO3��+H2O����C����
D��������Һ�м������������������Һ����Ӧ�����ӷ���ʽΪ��Al3++2SO42��+2Ba2++4OH���T2BaSO4��+AlO2��+2H2O����D��ȷ��
��ѡD��

 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�����Ŀ����ѧ���������������й㷺Ӧ�ã����ж�Ӧ��ϵ��ȷ����
ѡ�� | ��ѧ���� | ʵ��Ӧ�� |
A | ̼Ԫ�صķǽ����Աȹ�ǿ | ʯӢ��̼�۵Ļ��������·�Ӧ�Ʊ��ֹ� |
B | �Ҵ���ʹ�����ʱ��� | ��ˮ�Ҵ���ҽ�������� |
C | ������Һ������ | ��������ˮ�� |
D | ��֬�ڼ���������ˮ�� | �ȵ�NaOH��Һ����ֲ���ͺͿ����� |
A. A B. B C. C D. D
����Ŀ��ij�ػ�������ȡһ����ij�������ŷ�ˮ�����ֳɼס��ҡ��������ķݣ�������ͼ��ʾ̽����

��֪��ˮ�����п��ܺ����±��е����ӣ�
������ | Na+��Mg2+��X |
������ | Cl����SO32����Y��NO3�� |
��1������X�� ���ѧʽ����ͬ��������Y�� ��
��2�����в���ȷ���Ƿ���ڵ��������� ����֤�����������Ƿ���ڵļ�ʵ�����Ϊ ��
��3������ʵ�������������·�����Ӧ�����ӷ���ʽ�� ��