题目内容
【题目】氯及其化合物对人类生产及生活有重要作用。
(1)氯的原子结构示意图为_______;实验室氯气的尾气处理常用NaOH溶液,请用离子方程式表示该反应:________;工业上将氯气通入冷的消石灰制取漂白粉,漂白粉的有效成分是___(填化学式)。
(2)NaClO2的漂白能力是漂白粉的4到5倍。NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
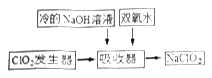
①发生器中用NaClO3与Na2SO3在酸性环境下反应制备ClO2,则氧化剂与还原剂的物质的量之比为:_____________。
②吸收器中生成NaClO2反应的离子方程式为_______,吸收器中的反应温度不能过高,可能的原因为__________。
③Cl2和ClO2均能将工业废水中得CN-氧化成无毒的物质,而自身被还原为Cl-,则处理相同量的CN-所需Cl2的质量是ClO2的多少倍。______(计算结果保留一位小数)。
【答案】  Cl2+2OH-=Cl-+C1O-+H2O Ca(C1O)2 2:1 ClO2+2OH-+H2O2=O2+2ClO2-+2H2O 双氧水受热容易分解 2.6
Cl2+2OH-=Cl-+C1O-+H2O Ca(C1O)2 2:1 ClO2+2OH-+H2O2=O2+2ClO2-+2H2O 双氧水受热容易分解 2.6
【解析】氯是17号元素,其原子由三个电子层,每层电子分别为2、8、7、其原子结构示意图为: 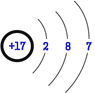
氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,对应的离子方程式为:Cl2+2OH-=Cl-+C1O-+H2O。漂白粉的成分是氯化钙、次氯酸钙,其有效成分是次氯酸钙。(2)①在反应过程中NaClO3反应生成ClO2,是氧化剂,过程为:NaClO3——ClO2,1mol NaClO3反应转移1mol电子,Na2SO3反应生成Na2SO4,是还原剂,过程为Na2SO3——Na2SO4,1mol Na2SO3反应转移2mol电子,此过程转移电子相等,故氧化剂与还原剂物质的量之比为2:1. ②在吸收器中是二氧化氯、氢氧化钠和双氧水反应,生成亚氯酸钠、氧气和水,对应的离子方程式为:ClO2+2OH-+H2O2=O2+2ClO2-+2H2O,此反应中的反应物双氧水受热易分解,故吸收器中温度不能太高。③处理相同量的CN-,转移的电子的物质的量是相等的,假设都为1mol。Cl2的反应过程为:Cl2——2Cl-,1mol Cl2反应转移2mol电子,则转移1mol电子需要Cl20.5mol,其质量为0.5mol×71g/mol=35.5g. ClO2的反应过程为ClO2——Cl-,1mol ClO2反应转移5mol电子,则转移1mol电子需要ClO20.2mol,其质量为:0.2mol×67.5g/mol=13.5g.所以Cl2的质量是ClO2的倍数为35.5/13.5=2.6