题目内容
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
A.与AlCl3溶液发生反应的离子方程式为Al3++3OH-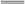 Al(OH)3↓ Al(OH)3↓ |
| B.其溶液的pH=13 |
| C.用适量水稀释后,NH3·H2O电离度和溶液pH都增大 |
| D.加水稀释后,溶液中c(NH4 +)·c(OH-)变小 |
D
解析试题分析:A.一水合氨是弱碱,不能写成离子形式。其与AlCl3溶液发生反应的离子方程式为Al3++3NH3·H2O= NH4++Al(OH)3↓。错误。B. 一水合氨是弱碱,在溶液中存在电离平衡:NH3·H2O NH4++OH-。c(OH-)<0.10 mol/L,其溶液的pH<13.错误。C.用适量水稀释后,NH3·H2O的电离平衡正向移动,所以电离度增大。由于稀释作用大于平衡移动使离子浓度增大的趋势,所以c(OH-)减小,溶液pH减小。错误。D.加水稀释后,溶液中c(NH4 +)、c(OH-)都减小,所以c(NH4 +)·c(OH-)变小。正确。
NH4++OH-。c(OH-)<0.10 mol/L,其溶液的pH<13.错误。C.用适量水稀释后,NH3·H2O的电离平衡正向移动,所以电离度增大。由于稀释作用大于平衡移动使离子浓度增大的趋势,所以c(OH-)减小,溶液pH减小。错误。D.加水稀释后,溶液中c(NH4 +)、c(OH-)都减小,所以c(NH4 +)·c(OH-)变小。正确。
考点:考查氨水参加的化学反应及溶液的pH、溶液稀释问题的知识。

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
25℃时,下列说法正确的是( )
| A.氨水与氯化铵的pH=7的混合溶液中:c(Cl—)>c(NH4+) |
| B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3—) >c(H2CO3)>c(CO32?) |
| C.pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后所得溶液显酸性 |
| D.将0.1 mol/L的氨水溶液加水稀释10倍,溶液中离子浓度都减少 |
下列说法不正确的是
| A.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| B.加热、蒸发MgCl2饱和溶液可得无水MgCl2晶体 |
| C.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 |
| D.室温下,c(NH4+)相等的(NH4)2SO4、NH4HCO3、NH4Cl溶液中:c(NH4)2SO4<c(NH4Cl)<c(NH4HCO3) |
有关AgCl的沉淀溶解平衡的说法正确的是
| A.AgCl沉淀生成和溶解同时在不断进行,且速率相等 |
| B.AgCl难溶于水,溶液中没有Ag+和Cl- |
| C.用等体积的蒸馏水和0.01mol·L-1的盐酸洗涤AgCl沉淀,用水洗涤造成的AgCl的损失小于用稀盐酸洗涤的损失量。 |
| D.向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀不变化 |
下列说法正确的是
| A.水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 |
| B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 |
C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(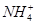 )/c(NH3·H2O)的值增大 )/c(NH3·H2O)的值增大 |
| D.室温下,CH3COOH的KW=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等 |
能使水的电离平衡右移,且水溶液显碱性的离子是( )
| A.H+ | B.OH- | C.Al3+ | D.HCO3- |
在25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀。最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如下:
| | AgCl | AgI | Ag2S |
| Ksp | 1.8×10-10 | 8.51×10-16 | 6.3×10-50 |
下列叙述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是
| A.MnS的Ksp比CuS的Ksp大 |
| B.该反应达平衡时c(Mn2+)=c(Cu2+) |
| C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数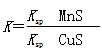 |
 =10-12。将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是( )
=10-12。将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是( )