题目内容
12.用KMnO4氧化密度为1.19g•cm-3.溶质质量分数为36.5%的HCl溶液.反应方程式如下:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
(1)请配平方程,并用双线桥法表示该反应电子转移情况
(2)盐酸的物质的量浓度11.9mol/L
(3)15.8gKMnO4能氧化0.5mol的HCl,转移电子数约为0.5NA.
分析 (1)氧化还原反应中失电子的元素化合价升高,得电子的元素化合价降低,根据得失电子守恒和原子守恒配平方程式,再由化合价降低数目=化合价升高数目=转移的电子数目分析;
(2)利用c=$\frac{1000ρw}{M}$计算浓度;
(3)根据反应转移的电子数、消耗和生成的各个物质的量的知识来计算.
解答 解:(1)反应中Mn元素的化合价从+7价降低到+2价,Cl元素的化合价从-1价升高到0价,结合原子守恒配平方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,则该反应电子转移的方向和数目如下所示: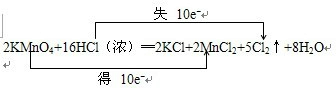 ,
,
故答案为:2、16、2、2、5、8; ;
;
(2)由c=$\frac{1000ρw}{M}$可知,浓度为$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L,
故答案为:11.9mol/L;
(3)高锰酸钾的量、氯气的量以及消耗的盐酸之间的关系为:2KMnO4~5Cl2~16HCl,被氧化的盐酸和参加反应的盐酸的量之比为:$\frac{10}{16}$,15.8g (即0.1mol)KMnO4完全反应时,消耗的HCl为0.8mol,被氧化的HCl为0.5mol,转移电子数为0.5NA;
故答案为:0.5;0.5NA.
点评 本题考查氧化还原反应,把握反应中元素化合价变化为解答的关键,注意从元素化合价角度分析,侧重氧化还原反应基本概念和离子反应的考查,题目难度不大.

练习册系列答案
相关题目
2.下列离子方程式正确的是( )
| A. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 次氯酸钠溶液中通入二氧化硫气体:2ClO-+SO2+H2O═2HClO+SO32- | |
| C. | 次氯酸钙溶液中通入过量的二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| D. | 少量NaHSO4与过量Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
3.下列叙述中,正确的是( )
| A. | 硫酸的摩尔质量是98g | B. | 1mol N2的质量为28g/mol | ||
| C. | 摩尔是物质的量的单位 | D. | 1mol氧的质量等于16g |
20.将2.4g Fe、Mg合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体VL(硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、灼烧后称量,质量为3.6g.则收集到的气体体积V的值不可能为( )
| A. | 1.02 | B. | 1.68 | C. | 1.00 | D. | 0.986 |
7.下列叙述中错误的是( )
| A. | H2SO4的摩尔质量是98 g•mol-1 | |
| B. | 2mol NO和2mol N2气体体积相等 | |
| C. | 等质量的O2和O3中所含氧原子个数相同 | |
| D. | 等物质的量的CO和CO2中所含碳原子数相等 |
17.一定温度下,在固定体积的密闭容器中进行下列反应
4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A. | 若单位时间内生成xmolNO的同时消耗x molNH3,则反应达到平衡状态 | |
| B. | 当混合气体的压强不再改变,则说明反应已达到平衡状态 | |
| C. | 当混合气体的密度不再改变,则说明反应已达到平衡状态 | |
| D. | 达到化学平衡后,若增大容器容积,正反应速率减小,逆反应速率增大 |
4.下列有机反应属于加聚反应的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | nCH2=CH2$\stackrel{一定条件}{→}$ | ||
| C. |  +HNO3$→_{加热}^{浓硫酸}$ +HNO3$→_{加热}^{浓硫酸}$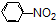 +H2O +H2O | D. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ |
1.下列说法不正确的是( )
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 反应条件是加热的反应不一定是吸热反应 | |
| C. | 放热反应的反应热总是大于吸热反应的反应热 | |
| D. | 化学反应放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量 |
2.下列关于物质应用和组成的说法正确的是( )
| A. | P2O5可用于干燥Cl2和NH3 | |
| B. | NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | CCl4不可用于鉴别溴水和碘水 | |
| D. | Si和SiO2都用于制造光导纤维 |