题目内容
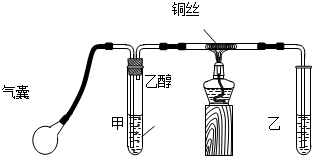
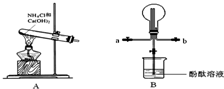
某小组利用如图装置制备氨气,并探究氨气的性质(部分仪器略去).请回答: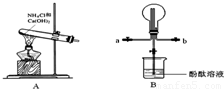
(1)实验室制备氨气的化学方程式为 .
(2)用B装置收集氨气时,请你选择氨气的进气口 (填“a”或“b”).
(3)B装置中烧瓶已收集满氨气,若使之形成喷泉,你的操作方法是 .若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是 .
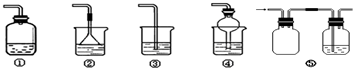
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是 (填序号).

(5)氨气在催化剂作用下并且加热时会被空气氧化,这是工业制硝酸的第一步反应,写出该反应的化学方程式 .
(6)氨气和氯气在常温下可快速反应生成氮气:2NH3+3Cl2=N2+6HCl.该反应可用于检验化工生产中氯气是否泄漏.因为氯气有少量泄漏,用氨气检验时会有明显现象,此过程中发生反应的Cl2和NH3的体积比范围为 .
【答案】分析:(1)实验室用加热铵盐和碱的固体混合物制取氨气;
(2)根据氨气与空气密度的相对大小判断排空气的方法,从而确定进气口;
(3)氨气极易溶于水,喷泉实验的原理是形成较大压强差;氨气溶于水生成氨水;
(4)氨气逸散到空气中造成环境污染,利用氨气极易溶于水的性质解答;
(5)氨催化氧化是硝酸工业的基础,根据氨催化氧化法制硝酸的原理解答;
(6)根据2NH3+3Cl2=N2+6HCl分析解答.
解答:解:(1)实验室用加热氯化氨和消石灰的固体混合物制取氨气,故答案为:2NH4Cl+Ca(OH)2 CaCl2+2NH3+2H2O;
CaCl2+2NH3+2H2O;
(2)氨气的式量为17,空气的平均式量为29,氨气密度小于空气的密度,所以要采用向下排空气法收集氨气,即a 为进气口,b为出气口,故答案为:a;
(3)氨气形成喷泉的原理是由于氨气极易溶于水,氨气溶于水而导致烧瓶内压强减小,从而形成喷泉,依据氨气形成喷泉的原理,如要形成喷泉,烧瓶内气体溶于水导致烧瓶内压强减小,外界大气压将烧杯内液体压入到烧瓶内,从而形成喷泉;氨气溶于水生成氨水,氨水电离出自由移动的氢氧根离子,所以溶液呈碱性,加入酚酞后溶液呈红色,
故答案为:打开下方止水夹,用手(或热毛巾)捂热烧瓶,使氨气受热膨胀,赶出玻璃管内空气,氨气与水接触形成喷泉;极易溶于水,与水反应生成碱;
(4)氨气是一种极易溶于水的气体,②导管口放一个漏斗,④球形干燥管,增大了与液体的接触面积,加入发生倒吸,漏斗体积较大,会使漏斗口很快的脱离液面,由于重力作用,液体又会回到烧杯中,防止了倒吸,⑤装置可作为安全瓶防倒吸,因为进气管较短(刚漏出瓶塞)若发生倒吸,倒吸液会被盛装在左瓶中,不会再倒流到前一装置,从而防止倒吸,
故答案为:②④⑤;
(5)氨催化氧化法制硝酸的步骤:氨气催化氧化为一氧化氮、一氧化氮和氧气反应生成二氧化氮、二氧化氮和水反应生成硝酸,
故答案为:4NH3+5O2 4NO+6H2O;
4NO+6H2O;
(6)氨气和氯气在常温下可快速反应生成氮气:2NH3+3Cl2=N2+6HCl.如果管道漏气,则发生反应3Cl2+2NH3=N2+6HCl,生成HCl气体继续与氨气反应生成氯化铵,现象为有白烟生成,
即氨气应过量,所以发生反应的Cl2和NH3的体积比为小于1.5,故答案为:小于1.5.
点评:本题考查氨气的制取和性质等知识,题目较为综合,具有一定难度,熟练掌握实验室中制取氨气的反应原理,氨气的性质,防倒吸的原理,是解答本题的关键.
(2)根据氨气与空气密度的相对大小判断排空气的方法,从而确定进气口;
(3)氨气极易溶于水,喷泉实验的原理是形成较大压强差;氨气溶于水生成氨水;
(4)氨气逸散到空气中造成环境污染,利用氨气极易溶于水的性质解答;
(5)氨催化氧化是硝酸工业的基础,根据氨催化氧化法制硝酸的原理解答;
(6)根据2NH3+3Cl2=N2+6HCl分析解答.
解答:解:(1)实验室用加热氯化氨和消石灰的固体混合物制取氨气,故答案为:2NH4Cl+Ca(OH)2
 CaCl2+2NH3+2H2O;
CaCl2+2NH3+2H2O;(2)氨气的式量为17,空气的平均式量为29,氨气密度小于空气的密度,所以要采用向下排空气法收集氨气,即a 为进气口,b为出气口,故答案为:a;
(3)氨气形成喷泉的原理是由于氨气极易溶于水,氨气溶于水而导致烧瓶内压强减小,从而形成喷泉,依据氨气形成喷泉的原理,如要形成喷泉,烧瓶内气体溶于水导致烧瓶内压强减小,外界大气压将烧杯内液体压入到烧瓶内,从而形成喷泉;氨气溶于水生成氨水,氨水电离出自由移动的氢氧根离子,所以溶液呈碱性,加入酚酞后溶液呈红色,
故答案为:打开下方止水夹,用手(或热毛巾)捂热烧瓶,使氨气受热膨胀,赶出玻璃管内空气,氨气与水接触形成喷泉;极易溶于水,与水反应生成碱;
(4)氨气是一种极易溶于水的气体,②导管口放一个漏斗,④球形干燥管,增大了与液体的接触面积,加入发生倒吸,漏斗体积较大,会使漏斗口很快的脱离液面,由于重力作用,液体又会回到烧杯中,防止了倒吸,⑤装置可作为安全瓶防倒吸,因为进气管较短(刚漏出瓶塞)若发生倒吸,倒吸液会被盛装在左瓶中,不会再倒流到前一装置,从而防止倒吸,
故答案为:②④⑤;
(5)氨催化氧化法制硝酸的步骤:氨气催化氧化为一氧化氮、一氧化氮和氧气反应生成二氧化氮、二氧化氮和水反应生成硝酸,
故答案为:4NH3+5O2
 4NO+6H2O;
4NO+6H2O;(6)氨气和氯气在常温下可快速反应生成氮气:2NH3+3Cl2=N2+6HCl.如果管道漏气,则发生反应3Cl2+2NH3=N2+6HCl,生成HCl气体继续与氨气反应生成氯化铵,现象为有白烟生成,
即氨气应过量,所以发生反应的Cl2和NH3的体积比为小于1.5,故答案为:小于1.5.
点评:本题考查氨气的制取和性质等知识,题目较为综合,具有一定难度,熟练掌握实验室中制取氨气的反应原理,氨气的性质,防倒吸的原理,是解答本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目