题目内容
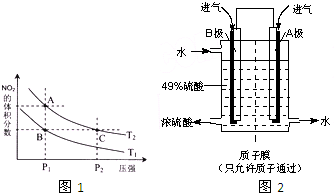 实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:(1)已知某反应的平衡表达式为:K=
| c(H2)?c(CO) |
| c(H2O) |
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g);△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g);△H=-41.3kJ?mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)0.2mol/L的NaOH与0.4mol/L的硝酸铵溶液等体积混合后,溶液中各离子的物质的量浓度从大到小的顺序是
(6)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图2,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触.
①溶液中H+的移动方向由
②B电极的电极反应式为
考点:物质的量或浓度随时间的变化曲线,热化学方程式,化学电源新型电池,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)根据平衡常数的定义判断反应的方程式;
(2)根据热化学方程式和盖斯定律计算得到所需热化学方程式;
(3)温度升高K值减小,所以正反应为放热反应;令CO的浓度变化为c,用三段式表示出各物质变化的浓度、平衡时的浓度,再根据平衡常数计算;
(4)从平衡移动的角度分析各物理量的变化;
(5)首先让两者反应生成的物质考虑电离和水解,最终确定离子浓度的大小;
(6)本题为SO2与O2反应生成SO3,SO3再与水化合生成硫酸,根据硫酸的出口判断正负极,负极发生氧化反应,正极发生还原反应,原电池放电时,电解质溶液中阳离子向正极移动.
(2)根据热化学方程式和盖斯定律计算得到所需热化学方程式;
(3)温度升高K值减小,所以正反应为放热反应;令CO的浓度变化为c,用三段式表示出各物质变化的浓度、平衡时的浓度,再根据平衡常数计算;
(4)从平衡移动的角度分析各物理量的变化;
(5)首先让两者反应生成的物质考虑电离和水解,最终确定离子浓度的大小;
(6)本题为SO2与O2反应生成SO3,SO3再与水化合生成硫酸,根据硫酸的出口判断正负极,负极发生氧化反应,正极发生还原反应,原电池放电时,电解质溶液中阳离子向正极移动.
解答:
解:(1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,平衡常数中,分子为生成物,分母为反应物,再结合质量守恒定律,所以该反应的方程式为C(s)+H2O(g)?CO(g)+H2(g),故答案为:C(s)+H2O(g)?CO(g)+H2(g);
(2)①2H2(g)+CO(g)?CH3OH(g);△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g);△H=-41.3kJ?mol-1
依据盖斯定律计算①×2+②+③得到总反应的热化学方程式:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-246.4KJ/mol;
故答案为:-246.4KJ/mol;
(3)温度升高K值减小,所以正反应为放热反应,
对于反应 CO(g)+H2O(g)?H2(g)+CO2(g),
开始(mol/L):0.02 0.02 0 0
变化(mol/L):c c c c
平衡(mol/L):0.02-c 0.02-c c c
所以
=9,解得c=0.015,
所以CO的转化率为
×100%=75%,
故答案为:放热;75%;
(4)对反应N2O4(g)?2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.则
A.A点压强小于C点的压强,压强越大,反应速率越大,则反应速率:A<C,故A错误;
B.增大压强,平衡向正反应移动,但浓度的增大幅度大于转化的程度,所以C点浓度大,颜色深,故B错误;
C.B、C两点二氧化氮的体积分数相同,则混合气体的平均相对分子质量相同,故C错误;
D.在相同压强下,升高温度,平衡向逆反应方向移动,则二氧化氮的体积分数增大,所以由状态B到状态A,可以用加热的方法,故D正确;
E.A、C两点的化学平衡常数,温度相同,平衡常数相等,故E错误;
故答案为:D;
(5)0.2mol/L的NaOH与0.4mol/L的硝酸铵溶液等体积混合后,得到等浓度的一水合氨、硝酸钠和硝酸铵的混合溶液,以一水合铵的电离为主,溶液呈碱性,所以c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+);
故答案为:c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+);
(6)该原电池中,负极上失电子被氧化,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,正极上投放的气体是氧气,正极上氧气得电子和氢离子反应生成水,根据硫酸和水的出口方向知,B极是负极,A极是正极,所以B极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,原电池放电时,氢离子由负极B移向正极A,所以其电池反应式为:2SO2+O2+2H2O=2H2SO4,
故答案为:B;A;SO2-2e-+2H2O═SO42-+4H+;
(2)①2H2(g)+CO(g)?CH3OH(g);△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g);△H=-41.3kJ?mol-1
依据盖斯定律计算①×2+②+③得到总反应的热化学方程式:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-246.4KJ/mol;
故答案为:-246.4KJ/mol;
(3)温度升高K值减小,所以正反应为放热反应,
对于反应 CO(g)+H2O(g)?H2(g)+CO2(g),
开始(mol/L):0.02 0.02 0 0
变化(mol/L):c c c c
平衡(mol/L):0.02-c 0.02-c c c
所以
| c×c |
| (0.02-c)×(0.02-c) |
所以CO的转化率为
| 0.015mol/L |
| 0.02mol/L |
故答案为:放热;75%;
(4)对反应N2O4(g)?2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.则
A.A点压强小于C点的压强,压强越大,反应速率越大,则反应速率:A<C,故A错误;
B.增大压强,平衡向正反应移动,但浓度的增大幅度大于转化的程度,所以C点浓度大,颜色深,故B错误;
C.B、C两点二氧化氮的体积分数相同,则混合气体的平均相对分子质量相同,故C错误;
D.在相同压强下,升高温度,平衡向逆反应方向移动,则二氧化氮的体积分数增大,所以由状态B到状态A,可以用加热的方法,故D正确;
E.A、C两点的化学平衡常数,温度相同,平衡常数相等,故E错误;
故答案为:D;
(5)0.2mol/L的NaOH与0.4mol/L的硝酸铵溶液等体积混合后,得到等浓度的一水合氨、硝酸钠和硝酸铵的混合溶液,以一水合铵的电离为主,溶液呈碱性,所以c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+);
故答案为:c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+);
(6)该原电池中,负极上失电子被氧化,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,正极上投放的气体是氧气,正极上氧气得电子和氢离子反应生成水,根据硫酸和水的出口方向知,B极是负极,A极是正极,所以B极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,原电池放电时,氢离子由负极B移向正极A,所以其电池反应式为:2SO2+O2+2H2O=2H2SO4,
故答案为:B;A;SO2-2e-+2H2O═SO42-+4H+;
点评:本题考查化学平衡常数、平衡移动相关计算、原电池原理应用、盐类水解判断等,题目较为综合,涉及多方面的知识,难度中等,本题中注意把握图象分析方法、原电池电极反应的书写应用.

练习册系列答案
相关题目
下列有关物质结构和性质的叙述正确的是:( )
①具有16个质子、16个中子和18个电子的微粒符号可表示为:1632S2-;
②羟基电子式为: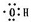 ;
;
③HClO的结构式:H-Cl-O;
④NaHCO3在水中的电离方程式:NaHCO3→Na++H++CO32-;
⑤Na2O的水溶液能导电,这不能说明Na2O是电解质;
⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;
⑦分馏、干馏、裂化都是化学变化.
①具有16个质子、16个中子和18个电子的微粒符号可表示为:1632S2-;
②羟基电子式为:
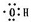 ;
;③HClO的结构式:H-Cl-O;
④NaHCO3在水中的电离方程式:NaHCO3→Na++H++CO32-;
⑤Na2O的水溶液能导电,这不能说明Na2O是电解质;
⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;
⑦分馏、干馏、裂化都是化学变化.
| A、①②⑤ | B、①④⑥⑦ |
| C、②③④⑥ | D、②③⑤⑥⑦ |
下列说法不正确的是( )
| A、盛有被KCl饱和溶液浸泡过的琼脂的U型管,可用作原电池的盐桥 |
| B、Al3+能水解为Al(OH)3胶体,明矾可用作净水剂 |
| C、甲醛能使蛋白质变性,可用作食品防腐剂 |
| D、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
 ,合成路线如下
,合成路线如下
 近年来,由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视.某研究小组利用反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,制备CO2与H2 的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用.
近年来,由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视.某研究小组利用反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,制备CO2与H2 的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用.