题目内容
【题目】下列关于电解质溶液的叙述正确的是
A. 室温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大
B. 将pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C. 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D. 室温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
【答案】A
【解析】弱电解质的电离程度受到温度、同离子效应、加与离子反应的物质、加水稀释等因素的影响,比较电解质溶液PH值大小要同一条件下看电离程度或者水解程度,比较电解质溶液中离子浓度可以考虑电荷守恒和物料守恒。
相同浓度和温度下H2CO3酸性比HCO3-强,所以Na2CO3的水解能力大于NaHCO3的水解能力,常温下,同浓度的Na2CO3溶液的pH大于NaHCO3溶液,A选项正确;pH=3的醋酸溶液稀释后,溶液稀释时Kw不变,而c(H+)减小,则c(OH-)增大,B选项错误;对于pH相等的HCl和CH3COOH,c(H+)相等,当二者体积相等时,电离的部分消耗碱一样多,但由于CH3COOH中存在电离平衡CH3COOH![]() H++CH3COO-,所以最终CH3COOH消耗NaOH的物质的量多,C选项错误;NH4Cl与氨水的混合溶液中,根据电荷守恒: c(NH4+) + c(H+)=c(OH―) + c(Cl―),因c(H+)=c(OH―),所以c(NH4+)=c(Cl―),则有:c(NH4+)=c(Cl―)>c(H+)>c(OH―),D选项错误;正确选项A。
H++CH3COO-,所以最终CH3COOH消耗NaOH的物质的量多,C选项错误;NH4Cl与氨水的混合溶液中,根据电荷守恒: c(NH4+) + c(H+)=c(OH―) + c(Cl―),因c(H+)=c(OH―),所以c(NH4+)=c(Cl―),则有:c(NH4+)=c(Cl―)>c(H+)>c(OH―),D选项错误;正确选项A。

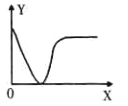
【题目】下列实验过程中对应的变化与右图相符合的是
实验过程 | X | Y |
| |
A | 稀HCl滴加到NaOH溶液中 | V(HCl) | N(Na+) | |
B | 铁粉加入 CuSO4溶液中 | m(Fe) | m(固 体) | |
C | CO2通入NaOH溶液中 | V(CO2) | 溶液的导电能力 | |
D | 稀H2SO4滴加到 Ba(OH)2溶液中 | V(H2SO4) | 溶液的导电能力 |
A. A B. B C. C D. D