题目内容
(2011?松江区模拟)下列说法正确的是( )
分析:A、依据PH是用溶液中氢离子浓度的负对数计算分析判断,氢离子浓度越小,PH越大;
B、依据碱溶液浓度和PH判断为弱碱进行分析判断;
C、依据醋酸是弱电解质存在电离平衡,溶液越稀电离程度越大
D、依据溶液中的电荷守恒结合溶液PH相同分析计算;
B、依据碱溶液浓度和PH判断为弱碱进行分析判断;
C、依据醋酸是弱电解质存在电离平衡,溶液越稀电离程度越大
D、依据溶液中的电荷守恒结合溶液PH相同分析计算;
解答:解:A、溶液的PH值越小,溶液中氢离子浓度越大,但不能说明含有氢离子数目多,和溶液体积有关,故A错误;
B、0.1mol?L-1一元碱BOH溶液的pH=10,判断为是弱碱,弱碱溶液存在电离平衡,是部分电离,存在关系BOH?B++OH-,故B错误;
C、0.1mol?L-1的醋酸变为0.01mol?L-1的醋酸,可以看做加水稀释10倍的结果,由于醋酸是弱电解质存在电离平衡,所以加水稀释促进电离;若是强酸稀释10倍,PH会增大一个数量级即a+1=b,但弱酸时,加水稀释体积变化的同时,也促进了电离,多生成了氢离子,故稀释后氢离子浓度的减少小于体积变化引起的减少,所以PH为a+1>b,故C正确;
D、pH相等的NaF与KAC溶液中分别存在电荷守恒为:[Na+]+[H+]=[F-]+[OH-];[K+]+[H+]=[AC-]+[OH-];pH相等说明氢离子浓度相同,同温度时氢离子浓度与氢氧根离子浓度乘积是常数,所以氢氧根离子浓度也相同,两式化简得到::[Na+]-[F-]=-[K+]-[AC-],故D错误;
故选C.
B、0.1mol?L-1一元碱BOH溶液的pH=10,判断为是弱碱,弱碱溶液存在电离平衡,是部分电离,存在关系BOH?B++OH-,故B错误;
C、0.1mol?L-1的醋酸变为0.01mol?L-1的醋酸,可以看做加水稀释10倍的结果,由于醋酸是弱电解质存在电离平衡,所以加水稀释促进电离;若是强酸稀释10倍,PH会增大一个数量级即a+1=b,但弱酸时,加水稀释体积变化的同时,也促进了电离,多生成了氢离子,故稀释后氢离子浓度的减少小于体积变化引起的减少,所以PH为a+1>b,故C正确;
D、pH相等的NaF与KAC溶液中分别存在电荷守恒为:[Na+]+[H+]=[F-]+[OH-];[K+]+[H+]=[AC-]+[OH-];pH相等说明氢离子浓度相同,同温度时氢离子浓度与氢氧根离子浓度乘积是常数,所以氢氧根离子浓度也相同,两式化简得到::[Na+]-[F-]=-[K+]-[AC-],故D错误;
故选C.
点评:本题考查了PH与氢离子浓度的大小关系比较,弱电解质的判断,弱电解质溶液稀释后PH的变化,电荷守恒的应用.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目

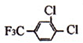 +
+
 +HCl
+HCl A发生缩聚反应
A发生缩聚反应 +nH2O
+nH2O 的含有三氟甲基(F3C一)和苯环的同分异构体共有
的含有三氟甲基(F3C一)和苯环的同分异构体共有