题目内容
某研究性学习小组欲利用已经学过的化学知识和下列装置制取少量次氯酸钠,并进一步探究次氯酸钠的化学性质。


相关资料:反应Cl2+2NaOH=NaClO+NaCl+H2O属于放热反应,温度稍高时便发生副反应:3Cl2+6NaOH=NaClO3+5NaCl+3H2O。
(1)制取氯气时,在烧瓶中加入一定量的二氧化锰,通过________(填写仪器名称)向烧瓶中加入适量的浓盐酸。请在装置A、B、C中选择一个合适的装置放在②处________。
(2)部分学生认为上述装置存在缺点,他们指出在前两个仪器之间应增加如D图所示的装置:你认为D中所盛液体是________,其作用是____________。

(3)该化学兴趣小组对产品的性质进行了如下探究。
第一步,测其pH=10。结合相关离子方程式解释原因________。
第二步,该化学兴趣小组的同学备选了紫色石蕊试液对次氯酸钠的性质进行实验检验。请你帮助他们完成实验报告:
实验操作 | 预期现象 | 结论 |
|
|
|
(1)分液漏斗 C
(2)饱和食盐水 除去Cl2中的HCl
(3)NaClO是强碱弱酸盐,水解呈碱性,ClO-+H2O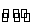 HClO+OH-
HClO+OH-
实验操作 | 预期现象 | 结论 |
取一干净试管,加入1~2 mL产品,然后滴加几滴紫色石蕊试液 | 先变蓝后褪色 | 次氯酸钠溶液具有碱性和氧化性(或漂白性) |
【解析】由于氯气和氢氧化钠反应是放热反应,且温度过高时,会发生副反应,所以选择装置C;由于盐酸易挥发,制得的Cl2中含有HCl杂质,所以需要加洗气装置;次氯酸钠溶液水解呈碱性;由于次氯酸钠溶液除呈碱性外还有漂白性,故加入紫色石蕊试液时先变蓝后褪色

练习册系列答案
相关题目





