题目内容
【题目】一定温度下,在2L的密闭容器中,M、N两种气体的物质的量随时间变化的曲线如图所示:
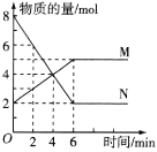
(1)反应的化学方程式为_______________。
(2)反应达到最大限度的时间是____min,该时间内的平均反应速率v(N)=____。
(3)判断该反应达到平衡状态的依据是(_______)(填序号)
A.该条件下,正、逆反应速率都为零
B.该条件下,混合气体的密度不再发生变化
C.该条件下,混合气体的压强不再发生变化
D.条件下,单位时间内消耗2mol N的同时,生成1mol M
(4)能加快反应速率的措施是(_______)(填序号)
A.升高温度 B.容器容积不变,充入惰性气体Ar
C.容器压强不变,充入惰性气体Ar D.使用催化剂
【答案】2N![]() M 6 0.5mol/(L·min) C AD
M 6 0.5mol/(L·min) C AD
【解析】
(1)反应进行到6min时N减少8mol-2mol=6mol,M增加5mol-2mol=3mol,减少的是反应物,增加的是生成物,其变化量之比等于化学计量系数比,因此反应的化学方程式为2N![]() M,故答案为:2N
M,故答案为:2N![]() M;
M;
(2)根据题图可知反应进行到6min时物质的物质的量不再发生变化,因此反应达到最大限度的时间是6min,该时间内的平均反应速率![]() ,故答案为:6 0.5mol/(L·min);
,故答案为:6 0.5mol/(L·min);
(3)A.达到平衡状态时正、逆反应速率相等,但不能为零,错误;
B.密度是混合气体的质量和容器容积的比值,在反应过程中质最和容积始终是不变的,因此该条件下,混合气体的密度不再发生变化不能说明反应达到平衡状态,错误;
C正反应体积减小,则该条件下,混合气体的压强不再发生变化能说明反应达到平衡状态,正确;
D该条件下,单位时间内消耗2mol N的同时,生成1mol M,均表示正反应速率,不能说明反应达到平衡状态,错误。
故答案为:C。
(4)
A.升高温度,反应速率加快,故A符合题意;
B.容器容积不变,充入惰性气体Ar,反应物浓度不变,反应速率不变,故B不符合题意;
C容器压强不变,充入惰性气体Ar,容器容积增大,反应物浓度减小,反应速率减小,故C不符合题意;
D使用催化剂,反应速率加快,故D符合题意;
故答案为:AD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某实验小组探究![]() 和
和![]() 的反应规律。实验操作及现象如下:
的反应规律。实验操作及现象如下:
实验及试剂 | 编号 | 无色 | 试管中溶液颜色 | 淀粉KI试剂颜色 |
| 1 | 0.5mL | 浅黄色 | 无色 |
2 | 0.20mL | 深黄色 | 无色 | |
3 | 0.25mL | 浅黄色 | 蓝色 | |
4 | 0.30mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如下实验:

经康康同学检验,上述白色沉淀是![]() 。写出加入0.20mL
。写出加入0.20mL ![]() 后,溶液中
后,溶液中![]() 和
和![]() 发生反应的离子方程式:____________。
发生反应的离子方程式:____________。
(2)查阅资料:一定条件下,![]() 和
和![]() 都可以被氧化成
都可以被氧化成![]() 。
。
作出假设:![]() 溶液用量增加导致溶液褪色的原因是过量的
溶液用量增加导致溶液褪色的原因是过量的![]() 溶液与(1)中的反应产物继续反应,同时生成
溶液与(1)中的反应产物继续反应,同时生成![]() 。进行实验:
。进行实验:
①取少量实验4中的无色溶液进行以下实验,进一步佐证其中含有![]() 。
。

其中试剂X可以是_________(填字母序号)。
a 碘水 b ![]() 溶液 c
溶液 c ![]() 溶液 d
溶液 d ![]() 溶液
溶液
②李政同学提出,仅通过润湿淀粉![]() 试纸变蓝的现象不能说明生成
试纸变蓝的现象不能说明生成![]() ,理由是_______,便补充了如下实验:将实验4中的湿润淀粉
,理由是_______,便补充了如下实验:将实验4中的湿润淀粉![]() 试纸替换为________,在滴加
试纸替换为________,在滴加![]() 溶液后,发现________,进一步佐证实验4中生成了
溶液后,发现________,进一步佐证实验4中生成了![]() 。
。