题目内容
氧化亚铁粉末和铝粉配成铝热剂,分成两等份。一份在高温下恰好完全反应后,在与盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体的质量比是
A.1:1 B.2:3 C. 3:2 D 28:9
A
解析试题分析:在铝热反应中Al失去的电子的物质的量与Fe得到的电子的物质的量相等。其置换出的Fe再与酸反应,产生的氢气得到的电子的物质的量与Fe得到的电子的物质的量相等,也就等于Al失去的电子的物质的量。在氧化亚铁粉末和铝粉配成铝热剂与足量的烧碱溶液中充分反应时Al失去的电子的物质的量与氢气得到的电子的物质的量相等。由于两份含有的Al相等,所以失去的电子的物质的量相等,因此两份产生的氢气的物质的量也相等。故选项是A。
考点:考查电子守恒在氧化还原反应中的应用的知识。

 阅读快车系列答案
阅读快车系列答案某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验: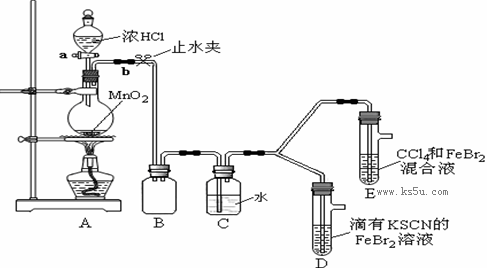
①检查气体发生装置A的气密性的操作是 。
②整套实验装置存在一处明显的不足,请指出: 。
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。 ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点约5℃,与水发生水解反应。 ⅲ.AgClO、AgBrO均可溶于水。 |
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因:
,
请设计简单实验证明上述解释: 。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因: 。
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为 。
将物质的量均为a mol的Na和Al一同投入m g足量水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度为
A. mol·L-1 mol·L-1 | B.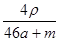 mol·L-1 mol·L-1 |
C.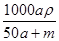 mol·L-1 mol·L-1 | D.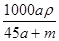 mol·L-1 mol·L-1 |
铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼
金属铝。下列说法不正确的是( ) 
| A.①、②中除加试剂外,还需要进行过滤操作 |
| B.a、b中铝元素的化合价相同 |
| C.③中需要通入过量的氨气 |
| D.④进行的操作是加热,而且d一定是氧化铝 |
下列根据实验事实得出的结论正确的是
| | 实 验 事 实 | 结 论 |
| A | 加热的铝箔熔化,但液态的铝不滴落 | 熔点:氧化铝>铝 |
| B | 溶液中加入盐酸酸化的BaCl2溶液有白色沉淀生成 | 该溶液中一定含有SO42- |
| C | 碳酸钠溶液能使酚酞试液变红 | 碳酸钠溶液呈碱性 |
| D | 常温下,铜与冷的浓H2SO4不反应 | 铜与浓硫酸发生钝化 |
下列关于Na、Mg及其化合物的说法正确的是
| A.钠在空气中燃烧生成Na2O |
| B.点燃的镁条在CO2中燃烧,生成氧化镁和碳 |
| C.钠保存在酒精中是因为酒精不与钠发生反应,且酒精的密度比钠小 |
| D.足量稀HCl加入Mg(OH)2沉淀中,加热蒸干得无水MgCl2固体 |
在硫酸铝、硫酸钾和明矾[KAl(SO4)2·12H2O]的混合溶液中,SO42—的浓度为0.4mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
| A.0.225mol/L | B.0.25mol/L | C.0.45mol/L | D.0.9mol/L |
下列表述正确的是
①开发使用新型清洁能源,减少化石燃料的燃烧,可从根本上防止酸雨的产生 ②我国从2000年起逐渐用二氧化氯取代氯气对饮用水进行消毒,因为二氧化氯杀菌、消毒能力强,持效长 ③氧化镁可用来制造耐火砖和坩埚等④明矾能使水中的悬浮物凝聚,可做为净水剂 ⑤建设三峡大坝使用了大量水泥,水泥是硅酸盐材料 ⑥给机动车安装尾气净化器,可减少光化学烟雾的发生
| A.①④⑤ | B.①②④⑤ | C.②③④⑥ | D.全部 |
已知:2[NaAl(OH)4]+CO2→2Al(OH)3↓+Na2CO3+H2O。向含2molNaOH、1molBa(OH)2、2mol[NaAl(OH)4]的混合液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系正确的是
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 3 |