题目内容
【题目】氮、磷、砷为同主族元素,回答下列问题:
(1)基态As原子的核外电子排布式为_______。
(2)镓氮砷合金材料的太阳能电池效率达40%,这3种元素的电负性由大至小的顺序是______ (用元素符号表示)
(3)As4O6的分子结构如左下图所示,其中As原子的杂化方式为______________,1 mol As406含有σ键的物质的量为_______。


(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右上图所示。则Y轴可表示的氢化物(RH3)性质可能是__________。
A.稳定性 B.沸点 C.R-H键能 D.分子间作用力
(5)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是_____________________
(6)NH4+中的H—N—H的键角比 NH3中的H—N—H的键角_______(填”大”或”小”),原因是_______________________________________________
【答案】 [Ar]3d104s24p3 N>As>Ga sp3 12mol AC NH3分子间能形成氢键,而As的原子半径比N的大,电负性比N的小,AsH3分子间不能形成氢键 大 NH4+中无孤电子对,而NH3中有一对孤电子对,对成键电子对的斥力大,导致NH3中的键角小于NH4+
【解析】(1)砷是33号元素,所以基态As原子的核外电子排布式为[Ar]3d104s24p3 。
(2)同一周期元素原子序数越大,电负性越大;同一主族元素,原子序数越小,电负性越大。镓、氮、砷这3种元素中,氮和砷是第VA族元素,氮的非金属性较强,所以氮的电负性较大;砷和镓都是第4周期元素,镓是31号元素,所以的电负性由大至小的顺序是N>As>Ga
(3)看图可知,As4O6的分子中每个砷原子与邻近的3个O原子形成σ键,每个砷原子还有一个孤电子对,所以As原子的杂化方式为sp3;每 个As4O6分子中有12个σ键,所以1 mol As406含有σ键的物质的量为12mol。
(4)同一主族元素的气态氢化物,非金属性越强的越稳定,其分子内的共价键的键能越大,所以Y轴可表示的氢化物(RH3)性质可能是AC。
(5)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是NH3分子间能形成氢键,而As的原子半径比N的大,电负性比N的小,AsH3分子间不能形成氢键。
(6)根据价层电子对互斥理论,孤电子对对成键电子对的斥力更大。由于NH4+中无孤电子对,而NH3中有一对孤电子对,对成键电子对的斥力大,导致NH3中的键角小于NH4+。

【题目】(14分)中学实验常用如图所示装置制取少量溴苯。在烧瓶a中装的试剂是苯、溴和铁粉。请填写下列空白。
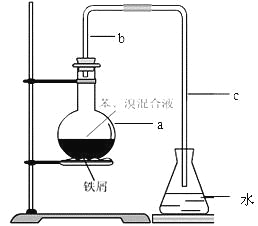
⑴导管b的作用有两个:一是导气,二是兼起 的作用;
⑵a中反应的化学方程式为 ;
⑶该实验得到的是粗苯,为了除去其中的溴,要用到的一种常用除杂操作方法是 ,提纯溴苯的具体步骤有:
①蒸馏;②水洗;③用干燥剂干燥;④10%NaOH溶液洗;⑤水洗 。
正确的操作顺序为( )
A.①②③④⑤ | B.②④⑤③① | C.④②③①⑤ | D.②④①⑤③ |
⑷为证明苯和溴发生的是取代反应而不是加成反应,可向水中加入 ;但该实验不够严密,为此必须在导管a、b之间加上一盛有 的洗气瓶,目的是 。

