题目内容
7.下列实验中,既属于氧化还原反应,又是放热反应的是( )| A. | 灼热的焦炭与CO2反应 | B. | 制水煤气的反应 | ||
| C. | 锌与硫酸溶液的反应 | D. | 水的分解反应 |
分析 含元素化合价变化的反应,为氧化还原反应;反应物总能量大于生成物总能量,则反应为放热反应,以此来解答.
解答 解:A.灼热的焦炭与CO2反应生成一氧化碳,C元素的化合价变化,为氧化还原反应,但为吸热反应,故A不选;
B.制水煤气的反应为碳和水蒸气反应生成氢气和一氧化碳,C、H元素的化合价变化,为氧化还原反应,但为吸热反应,故B不选;
C.锌与硫酸溶液的反应生成氯化锌和氢气,Zn、H元素的化合价变化,为氧化还原反应,且为放热反应,故C选;
D.水的分解生成氢气和氧气,O、H元素的化合价变化,反应为氧化还原反应,但为吸热反应,故D不选;
故选C.
点评 本题考查氧化还原反应和反应中的热效应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应、吸热反应判断的考查,注意归纳常见的放热、吸热反应及从元素化合价角度分析,题目难度不大.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
17.下列观点中,错误的是( )
| A. | 化学反应既能实现物质的转化、又能实现能量的转化 | |
| B. | 分子是保持物质化学性质的一种粒子 | |
| C. | 储存在物质中的化学能在化学反应前后是不变的 | |
| D. | 构成宏观物质的微观粒子之间的相互作用有多种形式,如离子键、共价键等 |
18.载人宇宙飞船中用太阳能电池和氢氧燃料电池进行供电.下列相关说法错误的是( )
| A. | 制造太阳能电池的材料是单质硅 | |
| B. | 太阳能电池将光能转化为化学能 | |
| C. | 氢氧燃料电池中氢气在负极反应 | |
| D. | 碱性氢氧燃料电池中正极区有OH?生成 |
15.用下列实验装置进行相应实验,能达到实验目的是(夹持装置未画出)( )
| A. |  检验溶液中是否有K+ | B. |  制取并收集少量NH3 | ||
| C. | 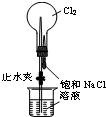 进行喷泉实验 | D. | 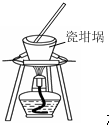 加热熔融NaOH固体 |
2.300℃、70MPa下二氧化碳和氢气合成乙醇已成为现实,2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g),下列叙述错误的是( )
| A. | 反应需在300℃进行可推测该反应是吸热反应 | |
| B. | 使用催化剂可大大提高生产效率 | |
| C. | 充入大量CO2气体可提高H2的转化率 | |
| D. | 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率 |
12.已知Cl2、Br2、FeCl3、I2的氧化性依次减弱.下列反应不可能发生的是( )
| A. | Cl2+2H Br=2HCl+Br2 | B. | Cl2+FeI2=FeCl2+I2 | ||
| C. | 3Cl2+6FeI2=2FeCl3+4FeI3 | D. | 2Fe3++2I-=2Fe2++I2 |

 Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl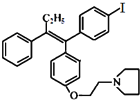 (不考虑立体结构).
(不考虑立体结构).


 D
D
 有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有6种.
有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有6种. 中任一种.
中任一种. +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +HBr.
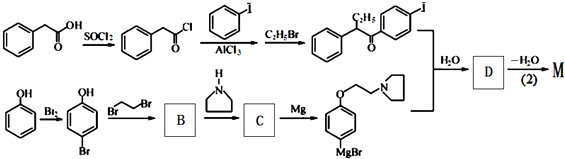
+HBr. 及含二个碳原子的有机化合物为原料,制备芳香醇
及含二个碳原子的有机化合物为原料,制备芳香醇 的合成路线
的合成路线 (不超过5步反应).
(不超过5步反应).