题目内容
“封管实验”具有简易、方便、节约、绿色等优点,观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是 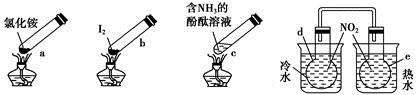

| A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体 |
| C.加热时,c中溶液红色变深,冷却后又变浅 |
| D.e内气体颜色变浅,d内气体颜色加深 |
B
A项说明NH4Cl的热稳定性不好;C项加热时NH3逸出,溶液红色变浅;D项???水中平衡向生成NO2的方向移动,气体颜色变深。

练习册系列答案
相关题目