题目内容
【题目】室温下,相同体积的0.5mol·L-1的下列四种溶液:①KCl溶液、②FeCl3溶液、③HF溶液、④Na2CO3溶液,其中所含阳离子数由多到少的顺序是( )
A. ④>①=②>③ B. ①>④>②>③ C. ④>①>③>② D. ④>②>①>③
【答案】D
【解析】
假设溶液体积为1L,分别计算溶液中溶质的物质的量,然后依据强电解质完全电离,弱电解质部分电离,弱碱阳离子、弱酸阴离子部分水解的性质判断解答。
假设溶液体积为1L,浓度均为0.5molL-1相同体积的下列四种溶液,含有KCl 物质的量为0.5mol,氯化钾为强电解质,完全电离所以含有钾离子物质的量为0.5mol;含有FeCl3物质的量为0.5mol,氯化铁为强电解质完全电离产生0.5mol三价铁离子,铁离子为弱碱阳离子,部分水解,所以溶液中三价铁离子水解:Fe3++3OH-![]() Fe(OH)3+3H+,所以阳离子物质的量大于0.5mol;含有HF物质的量为0.5mol,HF为弱电解质,部分电离,所以含有的氢离子小于0.5mol;含有碳酸钠的物质的量为0.5mol,碳酸钠为强电解质完全电离,产生1mol钠离子,所以含有阳离子物质的量为1mol;所以上述溶液中含有阳离子数目由多到少的顺序为:④>②>①>③,故选D。
Fe(OH)3+3H+,所以阳离子物质的量大于0.5mol;含有HF物质的量为0.5mol,HF为弱电解质,部分电离,所以含有的氢离子小于0.5mol;含有碳酸钠的物质的量为0.5mol,碳酸钠为强电解质完全电离,产生1mol钠离子,所以含有阳离子物质的量为1mol;所以上述溶液中含有阳离子数目由多到少的顺序为:④>②>①>③,故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
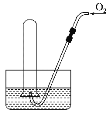
小学生10分钟应用题系列答案【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。

实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A. ③中白色浑浊是CaCO3
B. ②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C. 实验Ⅰ①中CO2过量发生的反应是:CO2+H2O+ S2== CO32+ H2S
D. 由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱