题目内容
【题目】根据元素周期表和元素周期律,判断下列叙述正确的是( )
A.气态氢化物的稳定性:CH4SiH4
B.氢元素与另一种元素形成的化合物一定是共价化合物
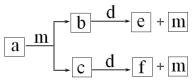
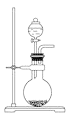
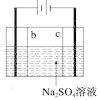
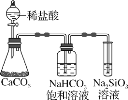
C.如图所示实验证明元素的非金属性:C>Si
D.用中文“![]() ”命名的第118号元素在周期表中位于第七周期VIII族
”命名的第118号元素在周期表中位于第七周期VIII族
【答案】C
【解析】
A.C与Si是同主族元素,Si在C的下方,非金属性C>Si,所以气态氢化物的稳定性:CH4>SiH4,A不正确;
B.氢元素与另一种元素形成的化合物可能是共价化合物(如H2O),也可能是离子化合物(如NaH),B不正确;
C.如图所示实验,反应发生装置中生成CO2,可能混有HCl气体,通过饱和NaHCO3溶液除去HCl气体,此时只有CO2和水蒸气,通入Na2SiO3溶液,将生成H2SiO3沉淀,说明酸性H2CO3>H2SiO3,从而证明元素的非金属性:C>Si,C正确;
D.用中文“![]() ”命名的第118号元素,其原子结构示意图为
”命名的第118号元素,其原子结构示意图为 ,所以其在周期表中位于第七周期0族,D不正确;
,所以其在周期表中位于第七周期0族,D不正确;
故选C。

 口算题天天练系列答案
口算题天天练系列答案【题目】七水硫酸锌别名皓矾,常用作媒染剂、收敛剂、木材防腐剂。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的流程如下:

在该流程中,相关离子生成氢氧化物的pH如表:
开始沉淀时pH | 完全沉淀时pH | |
Zn2+ | 5.4 | 6.4 |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Cu2+ | 5.6 | 6.4 |
请回答下列问题:
(1)粉碎氧化锌矿石的目的是______________;滤渣X的成分是________________。
(2)步骤Ⅱ中加入H2O2目的是:_______________,发生反应的离子方程式为:______________。
(3)“除铁”步骤中加入试剂M调节溶液的pH,试剂M可以是________(填化学式,一种即可),控制溶液的pH范围为:_________。同时还需要将溶液加热,其目的是:__________。
(4)滤渣Z的成分是____________。
(5)取28.70 g ZnSO4·7H2O(相对分子质量:287)加热至不同温度,剩余固体的质量变化如图所示:

①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是____________。
②680 ℃时所得固体的化学式为________________。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O