题目内容
【题目】科学家研究发现:硫化态的钴、钼、硫相互作用相(所谓“CoMoS”相)和噻吩(分子式为C4H4S)的加氢脱硫反应(C4H4S+4H2→C4H10+H2S)活性有线性关系。请回答下列有关问题:
(1)基态钴原子的外围电子排布图(轨道表示式)为___________。
(2)常温下,噻吩是一种无色、有恶臭、能催泪的液体,天然存在于石油中。
①1mol噻吩(![]() )中含有的
)中含有的![]() 键数目为___。
键数目为___。
②在组成噻吩的三种元素中,电负性最小的是__(填元素符号,下同);与S元素位于同一周期的非金属元素第一电离能由大到小的顺序为_______________。
(3)已知沸点:H2O>H2Se>H2S,其原因 __________。
(4)H2S在空气中燃烧可生成SO2,SO2催化氧化后得到SO3。
①写出与SO2互为等电子体的分子和离子:___、___(各一种)。
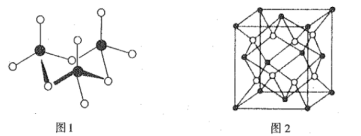
②气态SO3以单分子形式存在,其分子的立体构型为_____;固态SO3形成三聚体环状结(如图1所示),该分子中S原子的杂化轨道类型为______。
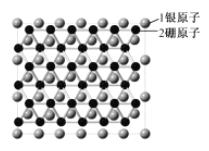
(5)Na2S的晶胞结构如图2所示,则黑球代表的离子是___。已知Na![]() 的半径为0.102nm,S2-的半径为0.184nm,根据硬球接触模型,则Na2S的晶胞参数a=__nm(列出计算式即可)。
的半径为0.102nm,S2-的半径为0.184nm,根据硬球接触模型,则Na2S的晶胞参数a=__nm(列出计算式即可)。
【答案】![]() 9NA H Cl>P>S>Si 水分子间存在氢键,沸点高;相对分子质量H2Se大,范德华力强,沸点比H2S高 O3 NO2-(或其他合理答案) 平面三角形 sp3 硫离子(或S2-) 0.661或
9NA H Cl>P>S>Si 水分子间存在氢键,沸点高;相对分子质量H2Se大,范德华力强,沸点比H2S高 O3 NO2-(或其他合理答案) 平面三角形 sp3 硫离子(或S2-) 0.661或![]()
【解析】
(1)基态钴原子的外围电子排布式为3d74s2,由此可得出其电子排布图(轨道表示式)。
(2)①在噻吩分子中,含有3个碳碳键、2个碳硫键、4个碳氢键,由此可得出1mol噻吩(![]() )中含有的
)中含有的![]() 键数目。
键数目。
②在组成噻吩的C、H、S三种元素中,电负性最小的是非金属性最弱的元素;与S元素位于同一周期的非金属元素有Si、P、S、Cl,它们的非金属性依次增强,但P的价电子轨道半充满,第一电离能反常,由此可得出第一电离能由大到小的顺序。
(3)已知沸点:H2O>H2Se>H2S,只有H2O分子间能形成氢键,而H2Se的相对分子质量比H2S大。
(4)①寻找与SO2互为等电子体的分子和离子,可从它们的相邻元素进行分析。
②气态SO3分子中,S的价层电子数为3,由此确定立体构型;固态SO3形成三聚体环状结构,该分子中S原子的价层电子对数为4,由此确定杂化轨道类型。
(5)Na2S的晶胞结构中,黑球有4个,而白球有8个,由此确定黑球代表的离子。晶胞参数为a,则体对角线为![]() a nm,体对角线上黑球与白球间的距离为体对角线长度的
a nm,体对角线上黑球与白球间的距离为体对角线长度的![]() ,从而得出
,从而得出![]() ×
×![]() a=0.102+0.184,由此求出a。
a=0.102+0.184,由此求出a。
(1)基态钴原子的外围电子排布式为3d74s2,则其电子排布图为![]() 。答案为:
。答案为:![]() ;
;
(2)①在噻吩分子中,含有3个碳碳键、2个碳硫键、4个碳氢键,且两原子间只能形成1个![]() 键,所以1mol噻吩(
键,所以1mol噻吩(![]() )中含有的
)中含有的![]() 键数目为9NA。答案为:9NA;
键数目为9NA。答案为:9NA;
②在组成噻吩的C、H、S三种元素中,电负性最小的是非金属性最弱的元素H;与S元素位于同一周期的非金属元素有Si、P、S、Cl,它们的非金属性依次增强,但P的价电子轨道半充满,第一电离能反常,则第一电离能由大到小的顺序为Cl>P>S>Si。答案为:H;Cl>P>S>Si;
(3)已知沸点:H2O>H2Se>H2S,只有H2O分子间能形成氢键,而H2Se的相对分子质量比H2S大,其原因为水分子间存在氢键,沸点高;相对分子质量H2Se大,范德华力强,沸点比H2S高。答案为:水分子间存在氢键,沸点高;相对分子质量H2Se大,范德华力强,沸点比H2S高;
(4)①寻找与SO2互为等电子体的分子和离子,可从它们的相邻元素进行分析,由此得出分子和离子为:O3、NO2-(或其他合理答案)。答案为:O3;NO2-(或其他合理答案);
②气态SO3分子中,S的价层电子数为3,则立体构型为平面三角形;固态SO3形成三聚体环状结构,该分子中S原子的价层电子对数为4,则杂化轨道类型为sp3。答案为:平面三角形;sp3;
(5)Na2S的晶胞结构中,黑球有4个,而白球有8个,则黑球代表的离子为硫离子(或S2-)。晶胞参数为a,则体对角线为![]() a,体对角线上黑球与白球间的距离为体对角线长度的
a,体对角线上黑球与白球间的距离为体对角线长度的![]() ,从而得出
,从而得出![]() ×
×![]() a=(0.102+0.184)nm,a=0.661nm或
a=(0.102+0.184)nm,a=0.661nm或![]() nm。答案为:硫离子(或S2-);0.661或
nm。答案为:硫离子(或S2-);0.661或![]() 。
。