题目内容
11.在FeCl3和CuCl2的混合物中加入过量的铁屑,充分反应后过滤,滤出固体的质量与加入铁屑的质量相等,则原混合物中FeCl3和CuCl2的物质的量之比为( )| A. | 2:3 | B. | 2:5 | C. | 2:7 | D. | 7:2 |
分析 在CuCl2和FeCl3组成的混合溶液中加入过量的铁粉,分别发生:2Fe3++Fe=3Fe2+,Fe+Cu2+=Fe2++Cu,充分反应后,所得不溶物的质量与加入铁粉的质量恰好相等,则消耗的铁的质量应等于生成的铜的质量,即两个反应中固体减少质量等于固体增加质量,据此解答.
解答 解:设原溶液中有x mol FeCl3,y mol CuCl2,则:
2Fe3++Fe═3Fe2+ 固体减少质量△m1
2mol 56 g
x mol 28x
Cu2++Fe═Fe2++Cu 固体增加质量△m2
1mol 8 g
y mol 8y g
因反应完毕后,剩余固体的质量恰好与所加铁粉的质量相等,则28x g=8y g,即x:y=8:28=2:7,
即原溶液中FeCl3与CuCl2物质的量之比是2:7,
故选C.
点评 本题考查混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,试题侧重考查学生分析计算能力,注意利用差量法进行解答.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
2.下列溶液中,溶质的物质的量浓度为1mol•L-1 的是( )
| A. | 将40g NaOH 溶于1L水所得的溶液 | |
| B. | 将22.4L HCl溶于水配成1L溶液 | |
| C. | 1L含2mol K+的K2SO4 溶液 | |
| D. | 将100mL 0.5mol•L-1 的NaNO3 溶液加热蒸发掉20g水 |
20.某种抗病毒药物M中含有C、H、O、N等元素,已知0.125mol药物M的质量是22.5g,则药物M的摩尔质量是( )
| A. | 225g•mol-1 | B. | 180g•mol-1 | C. | 90g•mol-1 | D. | 45g•mol-1 |
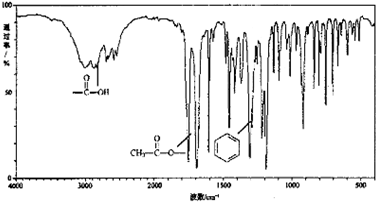
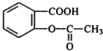 ,X在一定条件下能发生的反应是acd(选填字母);
,X在一定条件下能发生的反应是acd(选填字母);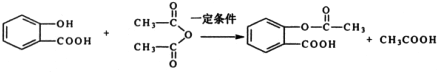

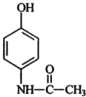 ,贝诺酯的结构简式是
,贝诺酯的结构简式是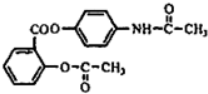
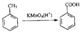 用邻甲基苯酚可以合成有机物X.合成路线如图:邻甲基苯酚→W→X的结构简则W的结构简式是
用邻甲基苯酚可以合成有机物X.合成路线如图:邻甲基苯酚→W→X的结构简则W的结构简式是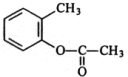 .
.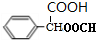 .
.