题目内容
(16分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:




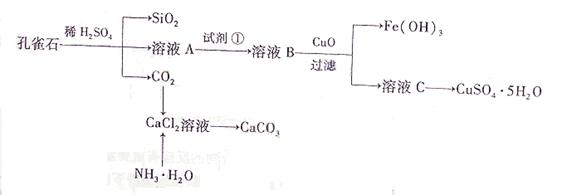

 请回答下列问题:
请回答下列问题:
 (1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
 a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
 (2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
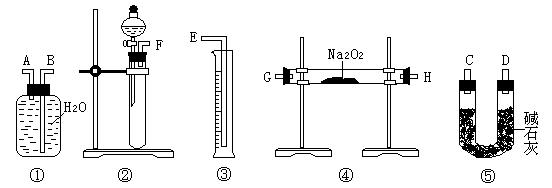
 (3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入) (填化学式)。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。
(3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入) (填化学式)。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。


 (4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应 ,直到 。用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应 ,直到 。用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。







 请回答下列问题:
请回答下列问题: (1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。 a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN (2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。 (3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入) (填化学式)。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。
(3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入) (填化学式)。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。



 (4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应 ,直到 。用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应 ,直到 。用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
 (1)c;d
(1)c;d(2)冷却结晶;引流
(3)NH3(或NH3·H2O);b d
(4)注视凹页面的最低处与刻度线,凹页面的最低处与刻度线相平;酸式
 (1)为使Fe2+、Fe3+一块沉淀,要加氧化剂将Fe2+氧化而又不引入新杂质,选H2O2;检验Fe3+ 选择SCN-(2)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流。(3)CaCl2溶液不能与CO2反应,加入碱能反应,但又不能引入杂质,应通入NH3(或先加入NH3·H2O);氨气极易溶于水,要注意防倒吸,a装置广口瓶内的进气管长,容易倒吸,c装置中的倒置漏斗、d中的多空球泡可以防倒吸。
(1)为使Fe2+、Fe3+一块沉淀,要加氧化剂将Fe2+氧化而又不引入新杂质,选H2O2;检验Fe3+ 选择SCN-(2)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流。(3)CaCl2溶液不能与CO2反应,加入碱能反应,但又不能引入杂质,应通入NH3(或先加入NH3·H2O);氨气极易溶于水,要注意防倒吸,a装置广口瓶内的进气管长,容易倒吸,c装置中的倒置漏斗、d中的多空球泡可以防倒吸。
练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
 8H20晶体和NH4Cl晶体反应过程中的能量变化⑤用蒸馏法分离两种沸点差距较大的液体⑥过滤分离互不相溶的固体和液体⑦用已知浓度的盐酸滴定待测浓度的NaOH溶液的酸碱中和滴定过程⑧稀释浓H2SO4的过程
8H20晶体和NH4Cl晶体反应过程中的能量变化⑤用蒸馏法分离两种沸点差距较大的液体⑥过滤分离互不相溶的固体和液体⑦用已知浓度的盐酸滴定待测浓度的NaOH溶液的酸碱中和滴定过程⑧稀释浓H2SO4的过程