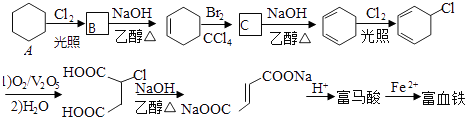
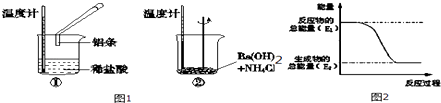
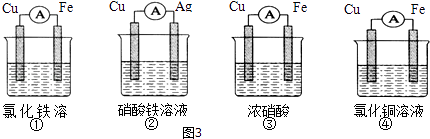
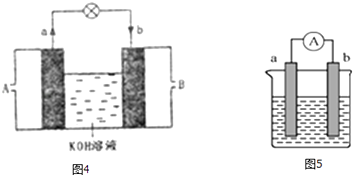
题目内容
【题目】下列叙述中一定正确的是
A.任何浓度溶液的酸碱性都可用pH试纸测定
B.某温度下,pH=6.2的纯水显酸性
C.25℃时,pH=1的醋酸溶液中c(H+)是pH=2的盐酸溶液中c(H+)的10倍
D.25℃时,pH=12的NaOH溶液中的n(OH-)=10-2mol
【答案】C
【解析】
试题分析:A、具有漂白性的溶液不能用pH试纸测定,比如:新制氯水不能用pH试纸测定酸碱性,最终试纸将褪为无色;B、pH=6.2的纯水,因为温度不确定,无法判断酸碱性,错误;C、25℃时,pH=1的醋酸溶液中c(H+)=10—1、pH=2的盐酸溶液中c(H+)=10—2,故C正确;D、不知道体积,无法计算。

练习册系列答案
相关题目