题目内容
【题目】根据题意解答
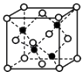
(1)某实验小组同学进行如下实验,以检验化学反应中的能量变化,实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是热反应,Ba(OH)28H2O与NH4Cl的反应是热反应.反应过程(填“①”或“②”)的能量变化可用图2表示. 
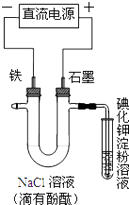
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是(填序号). 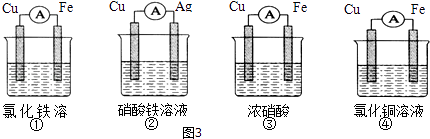
(3)将CH4设计成燃料电池,其利用率更高,装置如图4所示(a、b为多孔碳棒).处电极入口通甲烷(填A或B),其电极反应式为 . 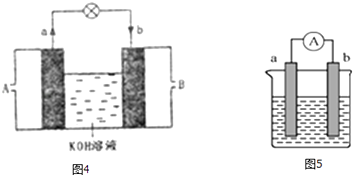
(4)如图5是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: ①当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为 .
②当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该原电池的正极为;该原电池的负极反应式为 .
【答案】
(1)放;吸;①
(2)②
(3)A;CH4﹣8e﹣+10OH﹣=CO32﹣+7H2O
(4)2H++2e﹣═H2↑;Mg;Al+4OH﹣﹣3e﹣=AlO2﹣+2H2O
【解析】解:(1)通过实验测出,反应前后①烧杯中的温度升高,则Al跟盐酸的反应是放热反应,②烧杯中的温度降低,则Ba(OH)28H2O跟NH4Cl的反应是吸热反应;根据图2数据可知,该反应中,反应物总能量大于生成物总能量,则该反应为放热反应,可表示反应①的能量变化,所以答案是:放;吸;①;(2)验证Fe3+与Cu2+氧化性强弱,在原电池中,铜作负极、其它导电的金属或非金属作正极,电解质溶液为可溶性的铁盐,①中铁作负极、Cu作正极,电池反应式为Fe+2Fe3+=3Fe2+ , 不能验证Fe3+与Cu2+氧化性强弱,故错误;②中铜作负极、银作正极,电池反应式为Cu+2Fe3+=Cu2++2Fe2+ , 能验证Fe3+与Cu2+氧化性强弱,故正确;③中铁发生钝化现象,Cu作负极、铁作正极,电池反应式为:Cu+2NO3﹣+4H+=Cu2++2NO2↑+2H2O,不能验证Fe3+与Cu2+氧化性强弱,故错误;④中铁作负极、铜作正极,电池反应式为:Fe+Cu2+=Cu+Fe2+ , 不能验证Fe3+与Cu2+氧化性强弱,故错误;所以答案是:②;(3)根据电子流向知,A为负极、B为正极,燃料电池中通入燃料的电极为负极、通入氧化剂的电极为正极,所以A处通入甲烷,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4﹣8e﹣+10OH﹣═CO32﹣+7H2O,所以答案是:A;CH4﹣8e﹣+10OH﹣═CO32﹣+7H2O(4)①Al、Cu、稀硫酸构成的原电池,金属Al作负极,金属Cu为正极,正极上氢离子得到电子,负极上Al失去电子,正极反应为2H++2e﹣=H2↑,所以答案是:2H++2e﹣=H2↑; ②Al、Mg、NaOH溶液可构成原电池,Al为负极,Mg为正极,负极上Al失去电子,正极上水中的氢离子得到电子,发生电池离子反应为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,所以答案是:Mg; Al+4OH﹣﹣3e﹣=AlO2﹣+2H2O.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热.