题目内容
13.NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 用石墨作电极电解饱和食盐水,阴极得2NA个电子时,阳极产生22.4 L气体 | |
| B. | 1mol二氧化硅晶体中含有2NA个硅氧键 | |
| C. | 在标准状况下,32g氧气和臭氧的混合气体中含氧原子数为2NA | |
| D. | 0.1L 3mol/L的NH4NO3溶液中含有的NH4+数目为0.3NA |
分析 A、阳极产生气体的状态不明确;
B、二氧化硅中含4条硅氧键;
C、氧气和臭氧均由氧原子构成;
D、NH4+是弱碱阳离子,在溶液中会水解.
解答 解:A、阳极产生气体的状态不明确,当阴极得2NA个电子时,阳极失去2NA个电子,则生成1mol氯气,但不一定是22.4L,故A错误;
B、二氧化硅中含4条硅氧键,故1mol二氧化硅中含4mol硅氧键即4NA个,故B错误;
C、氧气和臭氧均由氧原子构成,故32g混合物中含有的氧原子的物质的量为n=$\frac{32g}{16g/mol}$=2mol,即2NA个,故C正确;
D、NH4+是弱碱阳离子,在溶液中会水解,故溶液中的铵根离子的个数小于0.3NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
4.已知M、W、X、Y、Z是短周期中原子序数依次增大的5种主族元素,其中W、Z同族,M原子的最外层电子数是电子层数的3倍,元素X在同周期的主族元素中原子半径最大,Y是地壳中含量最多的金属元素.下列说法中正确的是( )
| A. | 气态氢化物稳定性最强的是HZ | |
| B. | 室温下,可用Y的容器盛装稀硝酸 | |
| C. | 原子半径由小到大的顺序为:rW<rM<rY | |
| D. | X的单质可通过电解XZ的水溶液获得 |
1.设NA为阿伏加德罗常数的值.下列说法错误的是( )
| A. | 标准状况下,18 g H2O中含有的质子数为10 NA | |
| B. | 标准状况下,2.24 L C12通入水中,反应转移的电子数为0.1 NA | |
| C. | 常温常压下,53.5 g NH4Cl晶体中含有共价键的数目为4 NA | |
| D. | 常温常压下,2 L 0.5 mol•L-1硫酸钾溶液中阴、阳离子总数大于3 NA |
8.如表实验方案中,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 向醋酸钠溶液中滴入酚酞试液,加热后若红色加深 | 证明盐类的水解是吸热的 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置.可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
18.下列离子反应方程式书写正确的是( )
| A. | Fe(OH)3 溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| B. | 向 NaAlO2 溶液中通入过量 CO2:AlO2+CO2+2H2O=Al(OH)3↓+HCO3- | |
| C. | 在强碱溶液中次氯酸钠与 Fe(OH)3 反应生成 Na2FeO4 :3ClO-+2Fe(OH)3=2FeO${\;}_{4}^{2-}$+3Cl-+H2O+4H+ | |
| D. | 向硫化钠溶液中滴入氯化铝溶液:2Al3++3S2-=Al2S3↓ |
5.下列物质中均含有酸性杂质,除去这些杂质的方法中正确的是( )
| A. | 乙醇中含乙酸杂质:加入足量氧化钙,蒸馏 | |
| B. | 制氯气时,依次通过饱和NaHCO3溶液和浓硫酸净化气体 | |
| C. | CO2中混有H2S通过足量的浓硫酸溶液洗气,以得到纯净的CO2 | |
| D. | 通过灼热的镁粉除去N2中的O2 |
2.将下列物质的溶液,加热蒸干并灼烧,能够得到原来物质的是( )
| A. | FeCl3 | B. | NaHCO3 | C. | MgSO4 | D. | Na2SO3 |
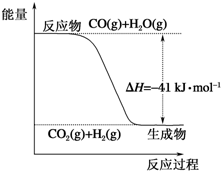 (1)根据图示写出热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1.
(1)根据图示写出热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ•mol-1.