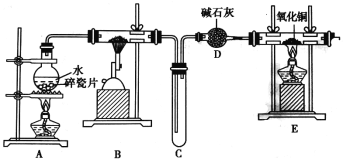
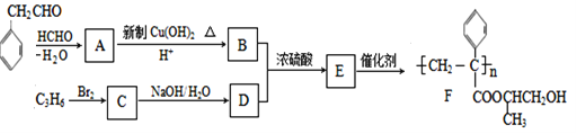
题目内容
【题目】下列事实不能用勒夏特列原理解释的是
A. 实验室用排饱和食盐水方法收集氯气
B. 氯水应保存在棕色细口瓶中,并处冷暗避光处保存
C. pH=3的醋酸溶液中加入CH3COONH4溶液,溶液pH增大
D. 将铜粉和锌粉混合后加入稀硫酸中,产生气体的速率比不加铜粉快
【答案】D
【解析】
有可逆才有平衡,有平衡才有平衡的移动。
A.氯气和水发生可逆反应:Cl2+H2O![]() HCl+HClO,饱和食盐水中大量氯离子的引入,使该反应平衡逆向进行,从而减小氯气的溶解损耗,A项不选;
HCl+HClO,饱和食盐水中大量氯离子的引入,使该反应平衡逆向进行,从而减小氯气的溶解损耗,A项不选;
B.氯气和水发生可逆反应:Cl2+H2O![]() HCl+HClO,生成的次氯酸见光、遇热易分解:2HClO
HCl+HClO,生成的次氯酸见光、遇热易分解:2HClO![]() 2HCl+O2↑,次氯酸的分解,使氯气与水的反应平衡向右移动,所以氯水用棕色细口瓶保存,并处于冷暗避光处,B项不选;
2HCl+O2↑,次氯酸的分解,使氯气与水的反应平衡向右移动,所以氯水用棕色细口瓶保存,并处于冷暗避光处,B项不选;
C.醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,pH=3的醋酸溶液中加入CH3COONH4溶液,相当于醋酸溶液中加入CH3COO-,平衡左移,溶液的pH增大,C项不选;
CH3COO-+H+,pH=3的醋酸溶液中加入CH3COONH4溶液,相当于醋酸溶液中加入CH3COO-,平衡左移,溶液的pH增大,C项不选;
D.铜粉、锌粉和稀硫酸形成了无数微小的原电池,加快了反应速率,这与可逆无关,也就与平衡移动无关,D项可选;
答案选D。

 步步高达标卷系列答案
步步高达标卷系列答案【题目】化工原料异丁烯(C4H8)可由异丁烷(C4H10)直接催化脱氢制备:C4H10(g) ![]() C4H8(g) + H2(g)ΔH=+139 kJ/mol
C4H8(g) + H2(g)ΔH=+139 kJ/mol
(1)该反应的化学平衡常数的表达式为_________________。
(2)一定条件下,以异丁烷为原料生产异丁烯。温度、压强改变对异丁烷平衡转化率的
影响如下图所示。
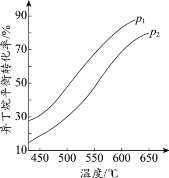
①判断p1、p2的大小关系:p1_________________(填“>”或“<”)p2,理由是_________________。
②若异丁烷的平衡转化率为40%,则平衡混合气中异丁烯的物质的量分数最多为______%(保留小数点后1位)。
(3)目前,异丁烷催化脱氢制备异丁烯的研究热点是催化活性组分以及载体的选择。下表是以V-Fe-K-O为催化活性物质,反应时间相同时,测得的不同温度、不同载体条件下的数据。
温度/℃ | 570 | 580 | 590 | 600 | 610 | |
以γ-Al2O3为载体 | 异丁烷转化率/% | 36.41 | 36.49 | 38.42 | 39.23 | 42.48 |
异丁烯收率/% | 26.17 | 27.11 | 27.51 | 26.56 | 26.22 | |
以TiO2为载体 | 异丁烷转化率/% | 30.23 | 30.87 | 32.23 | 33.63 | 33.92 |
异丁烯收率/% | 25.88 | 27.39 | 28.23 | 28.81 | 29.30 | |
说明:收率=(生产目标产物的原料量/原料的进料量)×100%
①由上表数据,可以得到的结论是____________(填字母序号)。
a.载体会影响催化剂的活性
b. 载体会影响催化剂的选择性
c.载体会影响化学平衡常数
②分析以γ-Al2O3为载体时异丁烯收率随温度变化的可能原因:___________。