题目内容
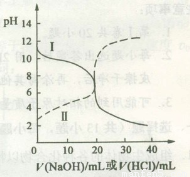
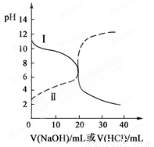
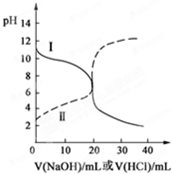 25℃时,取浓度均为0.1mol?L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol?L-1 NaOH溶液、0.1mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25℃时,取浓度均为0.1mol?L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol?L-1 NaOH溶液、0.1mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A、曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | B、曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | C、曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | D、曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
分析:根据未加盐酸和氢氧化钠时图象纵坐标所对应pH值可知,曲线Ⅰ线是盐酸滴定氨水,因为当未滴加溶液时,Ⅰ的pH>7;Ⅱ线是氢氧化钠滴定醋酸滴定氨水,因为当未滴加溶液时,曲线Ⅱ的pH<7;然后再根据溶液中的溶质离子的物料守恒、电荷守恒及溶液的酸碱性就可以解决问题.
解答:解:根据未加盐酸和氢氧化钠时图象纵坐标所对应pH值可知,曲线Ⅰ线是盐酸滴定氨水,因为当未滴加溶液时,Ⅰ的pH>7;Ⅱ线是氢氧化钠滴定醋酸滴定氨水,因为当未滴加溶液时,曲线Ⅱ的pH<7;
A.曲线I为酸滴定碱溶液,当滴加溶液到10mL时,溶液中的溶质是等物质的量浓度的氯化铵和一水合氨,由于在此条件下氨水的电离程度大于铵盐的水解程度,所以溶液呈碱性,则c(H+)<c(OH-),故A错误;
B.曲线I为酸滴定碱溶液,当滴加溶液到20mL时,溶液中的溶质是氯化铵,NH4+水解,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒c(Cl-)+c(OH-)=c(NH4+)+c(H+),得c(Cl-)>c(NH4+),盐类水解程度一般都较小,所以离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),故B错误;
C.曲线Ⅱ为氢氧化钠滴定醋酸溶液的曲线,滴加溶液在10 mL~20 mL之间存在,NaOH与醋酸反应,且NaOH的量不足,溶液中的溶质是醋酸钠和醋酸,此时醋酸电离程度大于醋酸根离子水解程度,则溶液中c(H+)>c(OH-),故C错误;
D.滴加溶液到10 mL时,溶液中的溶质是等物质的量浓度的醋酸和醋酸钠,根据物料守恒c(CH3COO-)+c(CH3COOH)=2c(Na+),和电荷守恒c(CH3COO-)+c(H+)=c(OH-)+c(Na+),得c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)],故D正确;
故选D.
A.曲线I为酸滴定碱溶液,当滴加溶液到10mL时,溶液中的溶质是等物质的量浓度的氯化铵和一水合氨,由于在此条件下氨水的电离程度大于铵盐的水解程度,所以溶液呈碱性,则c(H+)<c(OH-),故A错误;
B.曲线I为酸滴定碱溶液,当滴加溶液到20mL时,溶液中的溶质是氯化铵,NH4+水解,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒c(Cl-)+c(OH-)=c(NH4+)+c(H+),得c(Cl-)>c(NH4+),盐类水解程度一般都较小,所以离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),故B错误;
C.曲线Ⅱ为氢氧化钠滴定醋酸溶液的曲线,滴加溶液在10 mL~20 mL之间存在,NaOH与醋酸反应,且NaOH的量不足,溶液中的溶质是醋酸钠和醋酸,此时醋酸电离程度大于醋酸根离子水解程度,则溶液中c(H+)>c(OH-),故C错误;
D.滴加溶液到10 mL时,溶液中的溶质是等物质的量浓度的醋酸和醋酸钠,根据物料守恒c(CH3COO-)+c(CH3COOH)=2c(Na+),和电荷守恒c(CH3COO-)+c(H+)=c(OH-)+c(Na+),得c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)],故D正确;
故选D.
点评:本题考查了学生对电解质溶液中盐的水解和弱电解质的电离平衡的理解,并由此来判断溶液的酸碱性,再根据溶液中的电荷守恒和物料守恒来分析解答,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目