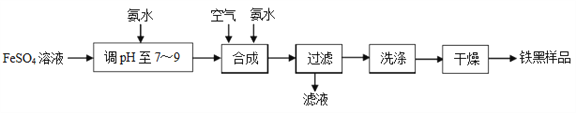
题目内容
【题目】碘化钠是一种白色结晶粉末,医疗上可用于甲状腺肿瘤防治剂、祛痰剂等。实验室用NaOH、单质碘和水合肼为原料制得,部分装置如下图所示。

实验步骤如下:
步骤①向三口烧瓶中加入8.2 gNaOH及30 mL水,搅拌冷却。
步骤②向制得的NaOH溶液中加入25.4 g单质碘,开动磁力搅拌器,保持6070℃至反应充分。
步骤③向步骤②所得溶液中加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得Nal溶液粗品和空气中常见的某气体。
步骤④向溶液③中加入1.0 g活性炭,煮沸半小时,然后将溶液与活性炭分离。
步骤⑤蒸发浓缩、结晶、过滤及干燥得产品24.3 g。
(1)步骤②温度不宜超过70℃的原因是__________;该步骤反应完全的现象是___________。
(2)步骤③N2 H4·H2O还原NaIO3的化学方程式为_______________。
(3)步骤④加入活性炭的目的是________;“将溶液与活性炭分离”的方法是__________。
(4)本次实验成品率为________。
【答案】 防止碘升华 无固体残留且溶液接近无色 3N2H4·H2O+2NaIO3=2NaI+3N2↑+9H2O 脱色(将多余的I2吸附除去) 趁热过滤 80.46%(81.0%也正确)
【解析】本题考查常见无机物质的制备实验的知识点。根据原料、反应原理、实验步骤可知:碘单质与NaOH溶液在6070℃反应生成NaIO和NaIO3,然后用N2H4·H2O(水合肼)将NaIO和NaIO3还原得到粗产物Nal,里面含有杂质碘单质,用活性炭吸附多余的碘单质进行脱色,趁热过滤,蒸发浓缩、结晶、过滤得到产品NaI。
(1)温度过高碘单质容易升华,影响产物的产率,答案为:防止碘升华;碘单质在水中溶解度很小,不能完全溶解,溶解的一部分溶液呈褐色,判断反应完全的标志是:无固体残留且溶液接近无色 。
(2)NaIO3与N2H4·H2O发生氧化还原反应色生成NaI和N2等产物,方程式为:3N2H4·H2O+2NaIO3=2NaI+3N2↑+9H2O
(3)实际反应中I2单质未完全反应,NaI中混有少量碘单质,导致NaI溶液显褐色,活性炭具有吸附性且不溶于水,可以吸附碘单质,对产物进行脱色处理;活性炭不溶于水,可在较高温度下使用过滤的方法除去多余的活性炭。答案为:脱色(将多余的I2吸附除去);趁热过滤
(4)反应物I2的物质的量为0.1mol,NaOH的物质的量为0.205mol,根据I2+2NaOH=NaI+NaIO+H2O,3I2+6NaOH=5NaI+NaIO3+3H2O,可知NaOH过量。根据I元素守恒,理论上应该得到NaI的物质的量为0.2mol,质量为0.2×150g=30g,剩余的NaOH的质量为0.205-0.1*2=0.005mol,质量为0.2g。成品率为 ![]() ×100%=80.46%。 或者作近似计算不考虑剩余的NaOH,则成品率为
×100%=80.46%。 或者作近似计算不考虑剩余的NaOH,则成品率为![]() ×100%=81%
×100%=81%