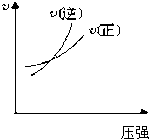
��Ŀ����
����Ŀ�������и��仯�У�EΪ��ɫ��ζ��Һ��(������),FΪ����ɫ��ĩ��GΪ��������ɫ����(��Ӧ��������ʡ��)���ش��������⣺
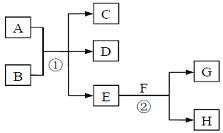
��1���ڷ�Ӧ���У�ÿ����2.24L����G(��״��)ʱ���÷�Ӧת�Ƶ��ӵ����ʵ�����____��
��2������Ӧ������Һ�н��У�A��C��D������Ԫ�أ���A����Ԫ�صĻ��ϼ۽���C��D֮�䡣��Ӧ�ٵ����ӷ���ʽ��__________��
��3������Ӧ���ڼ��������½��У���C��D�����־���ʹ�����ʯ��ˮ����ǵ���ɫ���壬��Ӧ�ٵĻ�ѧ����ʽ��_____________��
��4������Ӧ������Һ�н��У�A��һ��ǿ�B��һ����ʽ�Σ�D��һ�����壬��B������������������ڼ��������£���A����ʱ����Ӧ�ٵ����ӷ���ʽ��__________��
���𰸡� 0.2mol Cl2+2OH-=Cl-+ClO-+H2O C+2H2SO4��Ũ��![]() CO2��+2SO2��+2H2O Ca2++2OH-+NH4++HCO3-
CO2��+2SO2��+2H2O Ca2++2OH-+NH4++HCO3-![]() CaCO3��+NH3��+2H2O[KOH��Ba(OH)2������]
CaCO3��+NH3��+2H2O[KOH��Ba(OH)2������]
��������������������⿼�����ƶϡ�������EΪ��ɫ��ζ��Һ����EΪH2O��FΪ����ɫ��ĩ��F����H2O��Ӧ��FΪNa2O2��Na2O2��H2O��Ӧ�Ļ�ѧ����ʽΪ2Na2O2+2H2O=4NaOH+O2����GΪ��������ɫ���壬GΪO2��HΪNaOH��
��1����Ӧ��Ϊ2Na2O2+2H2O=4NaOH+O2������˫���ű������ת�Ʒ������ĿΪ��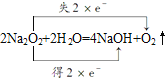 ������1molO2ת��2mol������n��O2��=
������1molO2ת��2mol������n��O2��=![]() =0.1mol����ת�Ƶ������ʵ���Ϊ0.2mol��
=0.1mol����ת�Ƶ������ʵ���Ϊ0.2mol��
��2������Ӧ������Һ�н��У�A��C��D������Ԫ�أ���A����Ԫ�صĻ��ϼ۽���C��D֮����EΪH2O����Ӧ��ΪCl2��OH-���绯��Ӧ����Ӧ�����ӷ���ʽΪCl2+2OH-=Cl-+ClO-+H2O��
��3������Ӧ���ڼ��������½��У���C��D�����־���ʹ�����ʯ��ˮ����ǵ���ɫ���壬��C��DΪCO2��SO2��EΪH2O����Ӧ��ΪC��Ũ����ķ�Ӧ����Ӧ���Ļ�ѧ����ʽΪC+2H2SO4��Ũ��![]() CO2��+2SO2��+2H2O��
CO2��+2SO2��+2H2O��
��4������Ӧ������Һ�н��У�A��һ��ǿ�B��һ����ʽ�Σ�D��һ�����壬ǿ������ʽ�η�Ӧ�������壬��DΪNH3��A����ΪKOH��Ca��OH��2��Ba��OH��2����BΪ��Σ�B�����������������B����Ϊ̼�����Ρ����������ε���B����ΪNH4HCO3��NH4HSO3�ȡ���AΪKOH�����������·�Ӧ�������ӷ���ʽ����Ϊ��2OH-+NH4++HCO3-![]() NH3��+CO32-+2H2O��2OH-+NH4++HSO3-
NH3��+CO32-+2H2O��2OH-+NH4++HSO3-![]() NH3��+SO32-+2H2O����AΪCa��OH��2�����������·�Ӧ�������ӷ���ʽ����Ϊ��Ca2++2OH-+NH4++HCO3-
NH3��+SO32-+2H2O����AΪCa��OH��2�����������·�Ӧ�������ӷ���ʽ����Ϊ��Ca2++2OH-+NH4++HCO3-![]() CaCO3��+NH3��+2H2O��Ca2++2OH-+NH4++HSO3-
CaCO3��+NH3��+2H2O��Ca2++2OH-+NH4++HSO3-![]() CaSO3��+NH3��+2H2O����AΪBa��OH��2�����������·�Ӧ�������ӷ���ʽ����Ϊ��Ba2++2OH-+NH4++HCO3-
CaSO3��+NH3��+2H2O����AΪBa��OH��2�����������·�Ӧ�������ӷ���ʽ����Ϊ��Ba2++2OH-+NH4++HCO3-![]() BaCO3��+NH3��+2H2O��Ba2++2OH-+NH4++HSO3-
BaCO3��+NH3��+2H2O��Ba2++2OH-+NH4++HSO3-![]() BaSO3��+NH3��+2H2O��
BaSO3��+NH3��+2H2O��