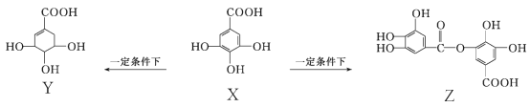
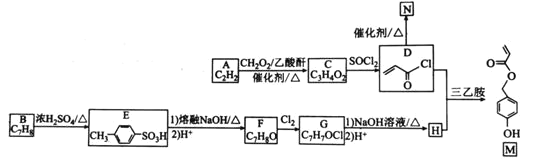
题目内容
【题目】K4[Fe(CN)6]可用作食盐的抗结剂,高温下K4[Fe(CN)6]会分解生成(CN)2、KCN、N2、Fe3C、C等物质。
(1)基态铁原子的价电子排布式为___;上述物质中涉及的几种元素的第一电离能由大到小的顺序为___;[Fe(CN)6]4-中,铁提供的空轨道数目是___。
(2)(CN)2分子中存在碳碳键,则(CN)2的立体构型是__,分子中σ键与π键数目之比为___;KCN与盐酸作用可形成HCN,HCN的中心原子的杂化轨道类型为___。
(3)已知Fe3C的晶胞结构中碳原子的配位数为6,与碳原子紧邻的铁原子的空间构型为___,铁原子的配位数是___。
(4)碳元素可形成多种结构和性质不同的单质,其中金刚石的熔点为3550℃,C60的熔点约为280℃,导致这种差异的原因是___。
(5)铁、镍位于同一族,若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为___。一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图2),已知O2-的半径为am,每平方米面积上分散的该晶体的质量为___g。(用a、NA表示)

【答案】3d64s2 N>C>Fe>K 6 直线形 3:4 sp 正八面体 2 金刚石是原子晶体,C60是分子晶体,前者原子间是靠强烈的共价键结合的,后者分子间是靠微弱的范德华力结合在一起的 (1,0.5,0.5) ![]()
【解析】
(1)Fe原子核外电子排布式为![]() ;IIA、VA族为全充满或半充满稳定状态,第一电离能高于同周期相邻元素;
;IIA、VA族为全充满或半充满稳定状态,第一电离能高于同周期相邻元素;![]() 与
与![]() 形成6个配位键;
形成6个配位键;
(2)(CN)2分子中存在碳碳键,结构式为![]() ,HCN结构式为
,HCN结构式为![]() ;
;
(3)Fe3C的晶胞结构中,以C原子为原点建立三维坐标系,Fe原子位于坐标轴上且关于原点![]() 碳原子
碳原子![]() 对称,6个Fe形成的空间结构为正八面体;配位数之比等于相应原子数目反比;
对称,6个Fe形成的空间结构为正八面体;配位数之比等于相应原子数目反比;
(4)金刚石是原子晶体,![]() 是分子晶体;
是分子晶体;
(5)由A、B参数,可知A处于坐标系的原点,晶胞中含有A原子的3个棱分别为坐标系的x、y、z轴,C为与晶胞右侧面,C到晶胞左侧面距离为参数x,到晶胞前平面距离为参数y,到晶胞下底面距离为参数z;由质量公式计算可得。
(1)Fe原子核外电子排布式为![]() ,处于过渡元素,除最外层外价电子还包含3d电子,故价电子排布式为:
,处于过渡元素,除最外层外价电子还包含3d电子,故价电子排布式为:![]() ;一般金属性越强第一电离能越小,同周期主族元素随原子序数增大第一电离能呈增大趋势,IIA、VA族为全充满或半充满稳定状态,第一电离能高于同周期相邻元素,故第一电离能:
;一般金属性越强第一电离能越小,同周期主族元素随原子序数增大第一电离能呈增大趋势,IIA、VA族为全充满或半充满稳定状态,第一电离能高于同周期相邻元素,故第一电离能:![]() ;
;![]() 与
与![]() 形成6个配位键,
形成6个配位键,![]() 中铁提供的空轨道数目是6,故答案为:
中铁提供的空轨道数目是6,故答案为:![]() ;
;![]() ;6;
;6;
(2)(CN)2分子中存在碳碳键,结构式为![]() ,C原子为sp杂化,故分子空间构型为:直线形,单键为
,C原子为sp杂化,故分子空间构型为:直线形,单键为![]() 键、三键含有1个
键、三键含有1个![]() 键、2个
键、2个![]() 键,分子中
键,分子中![]() 键与
键与![]() 键数目之比为3:4;HCN结构式为
键数目之比为3:4;HCN结构式为![]() ,中心碳原子的
,中心碳原子的![]() 键电子对数为2,孤电子对数为0,价层电子对数为2,故碳原子的杂化轨道类型为sp杂化,故答案为:直线形;3:4;sp;
键电子对数为2,孤电子对数为0,价层电子对数为2,故碳原子的杂化轨道类型为sp杂化,故答案为:直线形;3:4;sp;
(3)Fe3C的晶胞结构中碳原子的配位数为6,与碳原子紧邻的铁原子,以C原子为原点建立三维坐标系,Fe原子位于坐标轴上且关于原点![]() 碳原子
碳原子![]() 对称,6个Fe形成的空间结构为正八面体,故C原子的配位数为6,配位数之比等于相应原子数目反比,则Fe原子配位数为
对称,6个Fe形成的空间结构为正八面体,故C原子的配位数为6,配位数之比等于相应原子数目反比,则Fe原子配位数为![]() ,故答案为:正八面体;2;
,故答案为:正八面体;2;
(4)金刚石是原子晶体,![]() 是分子晶体,前者原子间是靠强烈的共价键结合的,后者分子间是靠微弱的范德华力结合在一起的,金刚石的熔点比
是分子晶体,前者原子间是靠强烈的共价键结合的,后者分子间是靠微弱的范德华力结合在一起的,金刚石的熔点比![]() 的熔点高,故答案为:金刚石是原子晶体,
的熔点高,故答案为:金刚石是原子晶体,![]() 是分子晶体,前者原子间是靠强烈的共价键结合的,后者分子间是靠微弱的范德华力结合在一起的;
是分子晶体,前者原子间是靠强烈的共价键结合的,后者分子间是靠微弱的范德华力结合在一起的;
(5)由A、B参数,可知A处于坐标系的原点,晶胞中含有A原子的3个棱分别为坐标系的x、y、z轴,C为与晶胞右侧面,C到晶胞左侧面距离为参数x,到晶胞前平面距离为参数y,到晶胞下底面距离为参数z,由B的参数可知晶胞是边长为1的正方体,则C的参数![]() 、
、![]() 、
、![]() ,平面NiO基本结构单元为
,平面NiO基本结构单元为 ,重复单元呈平行四边形,每个机构单元含有1个“NiO”,
,重复单元呈平行四边形,每个机构单元含有1个“NiO”,![]() 的半径为am,则结构单元的面积为:
的半径为am,则结构单元的面积为:![]() ,每平方米含有的结构单元数目
,每平方米含有的结构单元数目![]() ,即结构单元含有“NiO“数目,故每平方米面积上分散的该晶体的质量为
,即结构单元含有“NiO“数目,故每平方米面积上分散的该晶体的质量为![]()
![]() ,故答案为:
,故答案为:![]() ;
;![]() 。
。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案